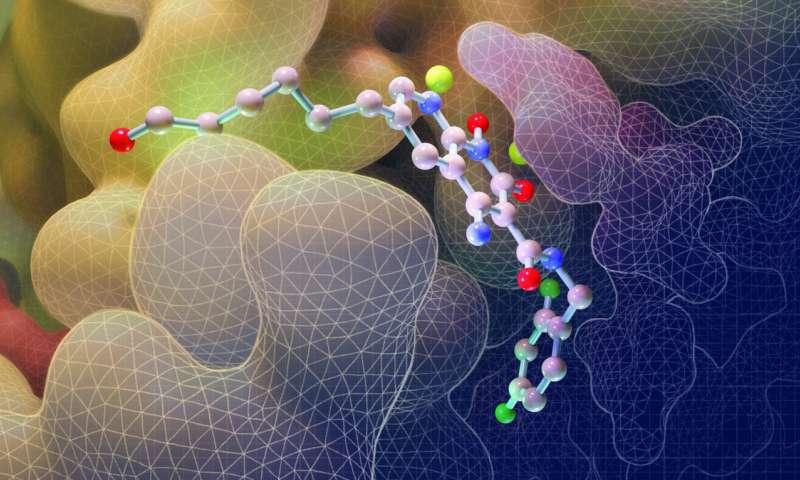
Immagine: questa illustrazione raffigura la struttura molecolare di un farmaco per l’HIV noto come INSTI durante un legame a siti chiave sull’intasoma (giallo), la macchina virale che consente all’HIV di invadere le cellule. Le sfere rosse rappresentano il DNA. Credito: Salk Institute
Gli scienziati di Salk Institute hanno scoperto come una potente classe di farmaci per l’HIV si lega a un pezzo chiave delle virus. Risolvendo, per la prima volta, le strutture tridimensionali di questo complesso mentre erano in azione diversi farmaci, i ricercatori hanno mostrato ciò che rende la terapia così potente.
Il lavoro, pubblicato su Science il 30 gennaio 2020, fornisce approfondimenti che potrebbero aiutare a progettare o migliorare nuovi trattamenti per l’HIV.
“I farmaci che abbiamo studiato sono gli ultimi composti disponibili oggi nella clinica, nonché diverse importanti molecole precliniche. Fino ad ora, nessuno sapeva esattamente come si legassero a questo complesso dell’HIV “, afferma l’autore senior dello studio Dmitry Lyumkis, un assistente Professore nel laboratorio di genetica del Salk.” Una migliore comprensione di come funzionano i farmaci ci aiuterà a migliorarli e progettare nuovi composti terapeutici “.
L’intasoma è una struttura cruciale del virus che consente l’infezione, composta dall’integrasi proteica dell’HIV e da filamenti di DNA virale che si formano quando il virus entra nelle cellule umane. L’intasoma si sposta in ogni cellula umana e quindi esegue le reazioni chimiche necessarie per integrare il materiale genetico del virus nel DNA umano.
Alcuni farmaci, chiamati inibitori del trasferimento del filo integrasi (INSTI), sono riusciti a bloccare l’intasoma; l‘HIV non può infettare le cellule umane quando il complesso non può integrare il DNA virale nel genoma umano. Attualmente ci sono quattro INSTI approvati dalla Food and Drug Administration degli Stati Uniti, così come altri in fase di sviluppo.
Nonostante il successo di queste molecole, i ricercatori hanno lottato per studiare come inibiscono l’intasoma dell’HIV, in gran parte a causa della difficoltà di isolare gli intasomi per gli studi strutturali. In passato, la maggior parte delle ricerche sull’intasoma e gli INSTI sono state condotte su un altro retrovirus chiamato prototipo di virus schiumoso o PFV. Nel 2017, Lyumkis e i suoi colleghi sono stati i primi a determinare la struttura degli intasomi di HIV purificati.
Nel nuovo lavoro, il team di Lyumkis ha fatto un ulteriore passo avanti: i ricercatori hanno ottenuto la struttura degli intasomi dell’HIV mentre venivano attivamente bloccati da uno dei quattro INSTI: il Bictegravir farmaco disponibile in commercio o da tre composti sperimentali noti come 4f, 4d e 4c. Il team ha utilizzato la microscopia crioelettronica a singola particella inclinata (cryo-EM), una tecnica di imaging che ha aiutato a rivelare la struttura di ciascun complesso di farmaci che inibiscono gli intasomi.
La prima osservazione che Lyumkis ha fatto è quanto diversamente i farmaci erano attaccati all’intasoma dell’HIV rispetto ai farmaci che erano stati osservati con l’intasoma del PFV. Il composto noto come 4f, ad esempio, si sposta indietro su se stesso mentre si lega all’intasoma PFV, ma rimane relativamente piatto quando si attacca alla versione HIV del complesso, dettagli che possono aiutare i ricercatori a migliorare le proprietà di legame di potenziali molecole future.
Vedi anche, Nuova scoperta sull’attività e la funzione delle cellule MAIT durante l’infezione acuta da HIV
“Fino ad oggi, tutti stanno ancora utilizzando la struttura intasoma PFV per razionalizzare e comprendere il meccanismo d’azione di questi farmaci”, afferma Dario Passos, co-primo autore dello studio e scienziato dello staff nel laboratorio di Lyumkis. “Ma abbiamo dimostrato che il campo deve davvero spostarsi e studiare la struttura dell’HIV se vogliamo fare ulteriori progressi”.
“Noi e molti altri abbiamo lavorato per questo obiettivo per diversi decenni ed è entusiasmante che finalmente possiamo capire nel dettaglio come gli inibitori dell’HIV lavorano e da questa comprensione sviluppare nuovi farmaci”, afferma Min Li, co-primo autore e scienziato del National Institute of Diabetes and Digestive and Kidney Diseases.
Le strutture hanno anche rivelato perché i farmaci sono così potenti e cosa li rende così bravi a evitare la resistenza ai farmaci. Lyumkis e i suoi colleghi, hanno scoperto che gli INSTI riempiono l’intero spazio normalmente occupato dal DNA. Ciò significa che se l’intasoma dell’HIV sviluppa una mutazione che impedisce ai farmaci INSTI di legarsi, impedisce anche al DNA di legarsi, rendendo il complesso inutile per invadere le cellule umane.
Infine, l’altissima risoluzione della struttura ottenuta dai ricercatori Salk consente loro di vedere i dettagli su come i farmaci hanno interagito chimicamente con questa tasca di legame e su come gli INSTIs hanno sostituito le molecole d’acqua per farlo, il che ha fornito al team ancora più informazioni su ciò che favorisce il successo degli INSTIs nella clinica.