Con l’adolescenza, il cervello contiene già la maggior parte dei neuroni necessari per il resto della vita. Tuttavia in alcune regioni continuano a crescere nuove cellule nervose e sono necessari i servizi di sentinelle cellulari e cellule immunitarie specializzate per sbarazzarsi delle cellule morte o disfunzionali.
Ora, gli scienziati Salk hanno individuato gli interruttori cellulari specifici che sono fondamentali per questo processo.
Il lavoro è stato descritto nella rivista Nature il 6 Aprile 2016.
“Abbiamo scoperto che i recettori sulle cellule immunitarie del cervello sono di vitale importanza sia per i neuroni sani che danneggiati”, dice Greg Lemke, autore senior del lavoro e Professore di neurobiologia molecolare al Salk Institute. “Questi recettori potrebbero essere potenziali bersagli terapeutici per malattie neurodegenerative o disturbi infiammatori come il morbo di Parkinson”.
Due decenni fa, il laboratorio Lemke ha scoperto che le cellule immunitarie esprimono molecole critiche chiamate recettori tirosin chinasici TAM, che sono da allora diventati un punto di riferimento per la ricerca sul cancro autoimmune in molti altri laboratori. Due dei recettori TAM, chiamati Mer e Axl, aiutano le cellule immunitarie chiamate macrofagi ad agire come spazzini, identificando e consumando gli oltre 100 miliardi di cellule morte che vengono generate in un corpo umano ogni giorno.
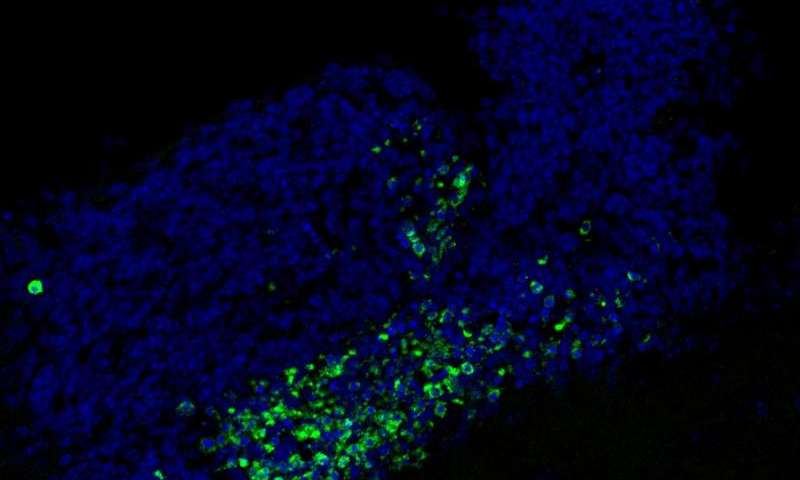
Per questo studio, il team ha cercato di scoprire se i recettori Mer e Axl svolgono lo stesso compito nel cervello. Macrofagi specializzati del sistema nervoso centrale chiamati microglia costituiscono circa il 10 per cento delle cellule del cervello, dove rilevano e distruggono gli agenti patogeni. I ricercatori hanno rimosso Axl e Mer nelle microglia di topi sani. Con loro sorpresa, hanno scoperto che l’assenza dei due recettori ha provocato un grande accumulo di cellule morte, ma non ovunque nel cervello. I cadaveri cellulari sono stati individuati solo nelle piccole regioni in cui si osserva la produzione di nuovi neuroni.
Molte cellule muoiono normalmente durante la neurogenesi adulta, ma sono subito spazzate via dalla microglia.
“E’ molto difficile individuare anche una sola cellula morta in un cervello normale, perché le cellule morte vengono riconosciute e liquidate immediatamente dalla microglia”, spiega Paqui G. Través, un co-autore dell’articolo ed ex socio di ricerca Salk. “Ma nelle regioni neurogene di topi privi Mer e Axl, abbiamo rilevato molte di queste cellule morte”.
Quando i ricercatori hanno esaminato più da vicino questo processo nei topi privi di Mer e Axl, hanno notato qualcosa di diverso ed interessante. I nuovi neuroni che migrano al bulbo olfattivo o centro dell’odore, aumentano drammaticamente in assenza di Axl e Mer. Topi privi dei recettori TAM hanno avuto un aumento del 70 per cento di cellule recentemente generate nel bulbo olfattivo, rispetto a topi normali.
Come e in che misura, questa nuova crescita neurale incontrollata colpisce il senso dell’odore di un topo non è ancora noto, ma il fatto che così tante cellule nervose nuove sono in grado di migrare nel bulbo olfattivo in assenza dei recettori, suggerisce che Mer e Axl hanno un altro ruolo oltre alla compensazione delle cellule morte.
“Sembra come se una frazione significativa di morte cellulare nelle regioni neurogeniche non è dovuta a morte intrinseca delle cellule, ma piuttosto è il risultato delle microglia stessa che uccide una parte delle cellule che causano l’ingolfamento” dice Lemke. “In altre parole, alcuni di questi progenitori neuronali neonati vengono in realtà mangiati vivi dalla microglia”.
“Questo processo non è necessariamente una cosa negativa nel cervello sano” aggiunge Lemke. Il cervello produce più neuroni di quello che può utilizzare e quindi molte nuove cellule non sono necessarie. Tuttavia, in un cervello infiammato o malato, la distruzione delle cellule può ritorcersi contro.
Il laboratorio Lemke ha fatto ancora una serie di esperimenti per comprendere il ruolo dei recettori TAM nella malattia. I ricercatori hanno osservato l’attività di Axl e Mer in un modello murino della malattia di Parkinson. Questo modello produce una proteina umana presente in una forma ereditaria della malattia che comporta una lenta degenerazione del cervello. Il team ha osservato che Axl era molto più attivo in questo ambiente, in linea con altri studi che dimostrano che l’aumento di Axl è un indicatore affidabile di infiammazione nei tessuti.
Ma i ricercatori sono stati sorpresi quando hanno eliminato Axl e Mer dai topi con il morbo di Parkinson. Invece di essere peggiorati rispetto ai topi con la malattia, ma con microglia normale, i topi mancanti di Axl e Mer in realtà sono vissuti più a lungo. Ciò può essere perché Axl e Mer distruggono i neuroni malati o disfunzionali. In presenza di malattie, ci potrebbero essere più neuroni disfunzionali del normale, così Axl e Mer possono innescare la distruzione di troppi neuroni, in effetti accelerando la malattia.
“Sembra che siamo in grado di modificare il decorso della malattia in un modello animale, manipolando Axl e Mer”, dice Lawrence Fourgeaud, un co-autore dell’articolo. Il team avverte tutta via, che molta più ricerca è necessaria per determinare se modulare i recettori TAM potrebbe essere una valida terapia per le malattie neurodegenerative che coinvolgono la microglia.
Fonte: Salk.edu