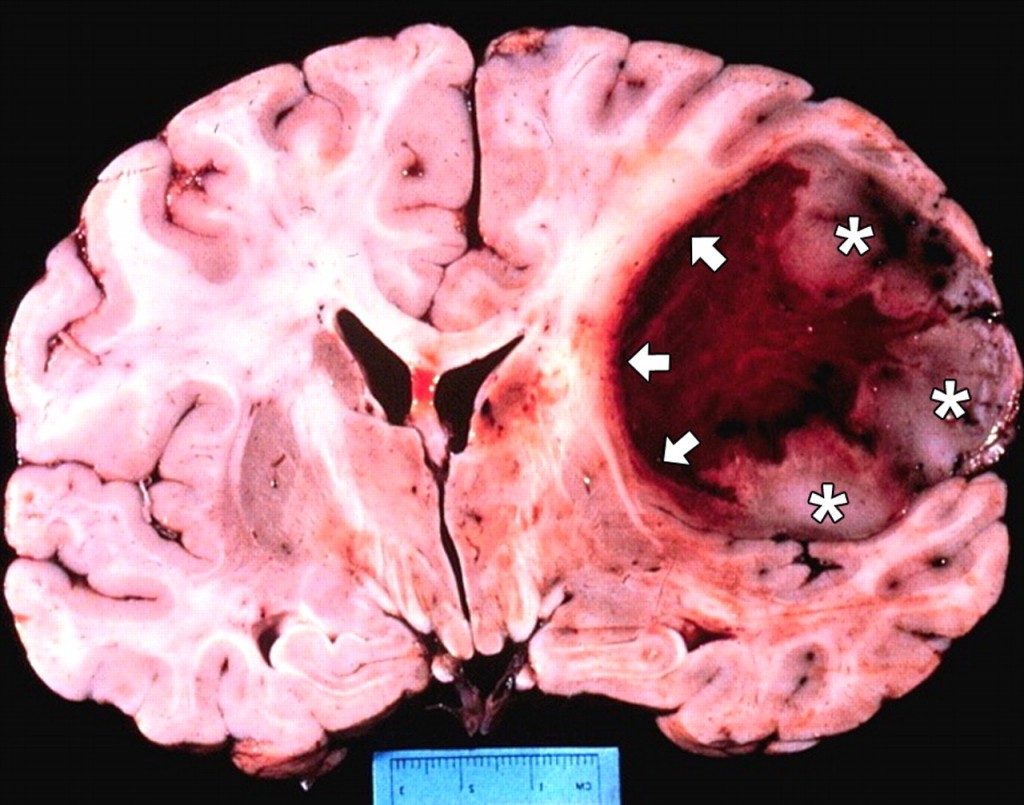
(Glioblastoma-Immagine Credit Public Domain).
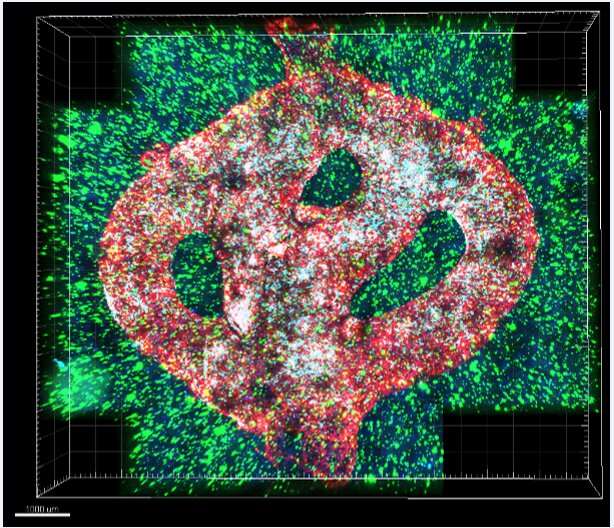
(Immagine microscopica del modello di glioblastoma biostampato in 3D. I vasi sanguigni biostampati sono ricoperti da cellule endoteliali (rosse) e periciti (ciano). I vasi sanguigni sono circondati da un tessuto che imita il cervello composto da cellule di gliblastoma (blu) e cellule del microambiente cerebrale (verde). Diversi farmaci o cellule possono essere perfusi attraverso i vasi sanguigni biostampati in 3D per testare il loro effetto sul tessuto tumorale. Credito: Università di Tel Aviv).
I ricercatori dell’Università di Tel Aviv hanno stampato un intero glioblastoma attivo e vitale utilizzando una stampante 3D. Il tumore biostampato in 3D include un complesso sistema di tubi simili a vasi sanguigni attraverso i quali possono fluire cellule del sangue e farmaci, simulando un vero tumore.
Lo studio è stato condotto dal Prof. Ronit Satchi-Fainaro. La nuova tecnologia è stata sviluppata da Lena Neufeld, insieme ad altri ricercatori del laboratorio del Prof. Satchi-Fainaro.
I modelli biostampati in 3D si basano su campioni di pazienti, prelevati direttamente dalle sale operatorie del Tel Aviv Sourasky Medical Center. I risultati del nuovo studio sono stati pubblicati oggi sulla rivista Science Advances.
“Il glioblastoma è il cancro più letale del sistema nervoso centrale, responsabile della maggior parte dei tumori maligni del cervello”, afferma il Prof. Satchi-Fainaro. “In uno studio precedente, abbiamo identificato una proteina chiamata P-Selectina, prodotta quando le cellule tumorali del glioblastoma incontrano la microglia-cellule del sistema immunitario del cervello. Abbiamo scoperto che questa proteina è responsabile di un guasto nella microglia, inducendole a supportare piuttosto che ad attaccare le cellule cancerose mortali, aiutando la diffusione del cancro. Tuttavia, abbiamo identificato la proteina nei tumori rimossi durante l’intervento chirurgico, ma non nelle cellule di glioblastoma coltivate su piastre di Petri in plastica in 2D nel nostro laboratorio. Il motivo è che il cancro, come tutti i tessuti, si comporta in modo molto diverso su una superficie plastica rispetto a quanto avviene nel corpo umano. Circa il 90% di tutti i farmaci sperimentali fallisce in fase clinica perché il successo ottenuto in laboratorio non si riproduce nei pazienti”.
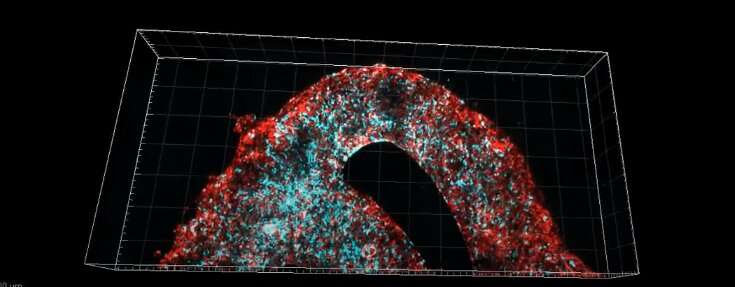
Per affrontare questo problema, il team di ricerca guidato dal Prof. Satchi-Fainaro e da Lena Neufeld, destinataria della prestigiosa Dan David Fellowship, ha creato il primo modello biostampato in 3D di un glioblastoma che include tessuto canceroso 3D circondato da matrice extracellulare che comunica con il suo microambiente tramite vasi sanguigni funzionali.
“Non sono solo le cellule tumorali”, spiega il Prof. Satchi-Fainaro. “Sono anche le cellule del microambiente nel cervello; gli astrociti, la microglia e i vasi sanguigni collegati a un sistema microfluidico, vale a dire un sistema che ci consente di fornire sostanze come le cellule del sangue e farmaci alla replica tumorale. Ogni modello viene stampato in un bioreattore da noi progettato in laboratorio, utilizzando un idrogel campionato e riprodotto dalla matrice extracellulare prelevata dal paziente, simulando così il tessuto stesso. Le proprietà fisiche e meccaniche del cervello sono diverse da quelle di altri organi, come la pelle, il seno o le ossa. Il tessuto mammario consiste principalmente di grasso, il tessuto osseo è principalmente calcio; ogni tessuto ha le sue proprietà che influenzano il comportamento delle cellule tumorali e il modo in cui rispondono ai farmaci. Coltivare tutti i tipi di cancro su superfici plastiche identiche non è una simulazione ottimale del contesto clinico”.
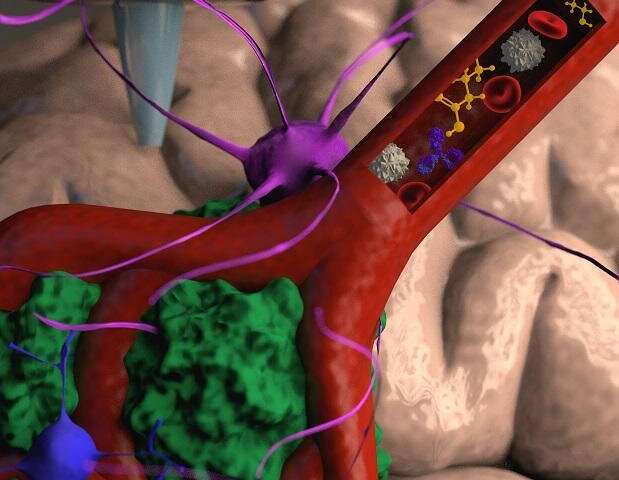
Dopo aver stampato con successo il tumore 3D, il Prof. Satchi-Fainaro e i suoi colleghi hanno dimostrato che, a differenza delle cellule tumorali che crescono su piastre di Petri, il modello biostampato in 3D ha il potenziale per essere efficace per una previsione rapida, robusta e riproducibile del trattamento più adatto per un paziente specifico.
“Abbiamo dimostrato che il nostro modello 3D è più adatto per la previsione dell’efficacia del trattamento, la scoperta di target e lo sviluppo di farmaci in tre modi diversi. In primo luogo, abbiamo testato una sostanza che inibiva la proteina che avevamo scoperto di recente, la P-Selectina, in colture cellulari di glioblastoma coltivate su piastre di Petri 2D, e non abbiamo riscontrato differenze nella divisione e migrazione cellulare tra le cellule trattate e le cellule di controllo che non hanno ricevuto alcun trattamento . Al contrario, sia nei modelli animali che nei modelli biostampati in 3D, siamo stati in grado di ritardare la crescita e l’invasione del glioblastoma bloccando la proteina P-Selectina. Questo esperimento ci ha mostrato perché i farmaci potenzialmente efficaci raramente raggiungono la clinica semplicemente perché falliscono i test nei modelli 2D e viceversa: perché i farmaci considerati un successo fenomenale in laboratorio, alla fine falliscono negli studi clinici. Inoltre, collaborando con il laboratorio del Dr. Asaf Madi del Dipartimento di Patologia della Facoltà di Medicina, abbiamo condotto il sequenziamento genetico delle cellule tumorali cresciute nel modello biostampato in 3D e le abbiamo confrontate sia con le cellule tumorali cresciute su plastica 2D che con le cellule tumorali prelevate dai pazienti.
Vedi anche:Dispositivo magnetico sperimentale riduce il glioblastoma
Pertanto, abbiamo dimostrato una somiglianza maggiore tra i tumori biostampati in 3D e le cellule di glioblastoma derivate dal paziente cresciute insieme alle cellule stromali del cervello nel loro ambiente naturale. Nel tempo, le cellule tumorali cresciute sulla plastica sono cambiate considerevolmente, perdendo infine ogni somiglianza con le cellule tumorali nel campione di tumore al cervello del paziente. La terza prova è stata ottenuta misurando il tasso di crescita del tumore. Il glioblastoma è una malattia aggressiva in parte perché imprevedibile: quando le cellule tumorali eterogenee vengono iniettate separatamente in animali modello, in alcuni il cancro rimarrà dormiente, mentre in altri si svilupperà rapidamente in un tumore attivo. Questo ha senso perché noi, come esseri umani, possiamo morire pacificamente di vecchiaia senza mai sapere di aver ospitato tali tumori dormienti. Sul piatto in laboratorio, tuttavia, tutti i tumori crescono alla stessa velocità e si diffondono alla stessa velocità. Nel nostro tumore biostampato in 3D, l’eterogeneità viene mantenuta e lo sviluppo è simile all’ampio spettro che vediamo nei pazienti o nei modelli animali”.

Secondo il Prof. Satchi-Fainaro, questo approccio innovativo consentirà anche lo sviluppo di nuovi farmaci, nonché la scoperta di nuovi bersagli farmacologici, a un ritmo molto più rapido rispetto a oggi. Si spera che in futuro questa tecnologia faciliterà la medicina personalizzata per i pazienti.
“Se prendiamo un campione dal tessuto di un paziente, insieme alla sua matrice extracellulare, possiamo biostampare in 3D da questo campione 100 minuscoli tumori e testare molti farmaci diversi in varie combinazioni per scoprire il trattamento ottimale per questo specifico tumore. In alternativa, possiamo testare numerosi composti su un tumore biostampato in 3D e decidere quale è più promettente per ulteriori sviluppi e investimenti come potenziale farmaco, ma forse l’aspetto più eccitante è trovare nuove proteine e geni bersaglio farmacologici nel cancro, un compito molto difficile quando il tumore si trova all’interno del cervello di un paziente umano o di un animale modello. La nostra innovazione ci offre un accesso senza precedenti, senza limiti di tempo, ai tumori 3D che imitano meglio lo scenario clinico, consentendo un’indagine ottimale“.
Fonte:Science