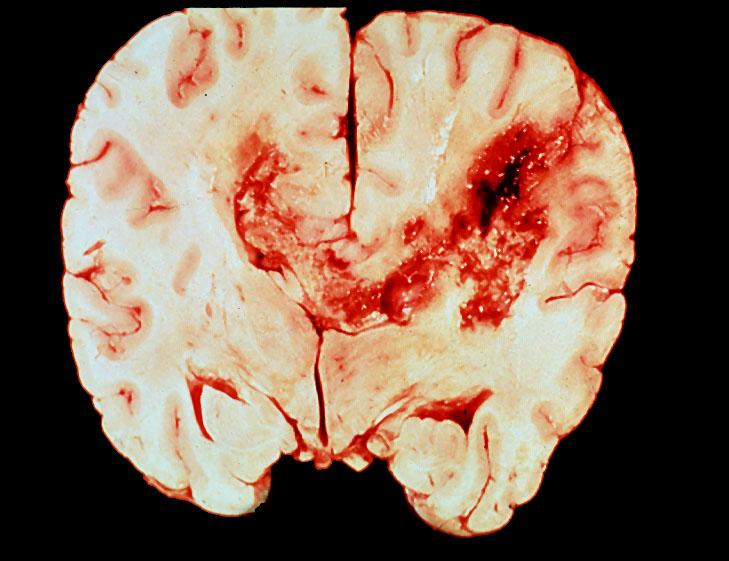
Il Glioblastoma multiforme (GBM) e un cancro al cervello aggressivo e incurabile. Ora un gruppo di ricerca della Northwestern University è il primo a dimostrare che la consegna di un farmaco che spegne un gene critico per questo tipo di tumore complesso, aumenta significativamente i tassi di sopravvivenza negli animali con questa malattia.
Il nuovo trattamento terapeutico, basato sulla nanotecnologia, è piccolo e agile abbastanza per attraversare la barriera emato-encefalica e arrivare dove è necessario “al tumore al cervello”. Progettato per indirizzare uno specifico gene che causa il cancro nelle cellule, il farmaco gira semplicemente l’interruttore dell’ oncogene fastidioso su “off”,ossia provoca il silenziamento del gene. Questo mette fuori gioco le proteine che rendono le cellule tumorali immortali.
In uno studio su topi, il farmaco non tossico è stato consegnato per iniezione endovenosa in animali con glioblastoma multiforme (GBM). Il loro tasso di sopravvivenza è aumentato quasi del 20 per cento e la dimensione del tumore è stata ridotta 3-4 volte, rispetto al gruppo di controllo.
I risultati dello studio sono stati pubblicati il 30 ottobre in Science Translational Medicine .
“Questo è un” bellissimo matrimonio” di una nuova tecnologia con i geni di una malattia terribile”, ha detto Chad A. Mirkin, un esperto di nanomedicina e co-autore senior dello studio.”Utilizzando acidi nucleici sferici altamente adattabili, abbiamo specificamente mirato un gene associato con il glioblastoma multiforme e l’abbiamo spento in vivo. Questa-of-concept prova stabilisce inoltre una vasta piattaforma per il trattamento di una vasta gamma di malattie, dal cancro del polmone e del colon all’artrite reumatoide e psoriasi. ”
La ricerca è fondamentale per i pazienti con glioblastoma: il tasso di sopravvivenza media è di 14/16 mesi e circa 16.000 nuovi casi sono segnalati negli Stati Uniti, ogni anno.
Nella loro partnership di ricerca, Mirkin aveva trovato lo strumento perfetto per affrontare il cancro mortale: gli acidi nucleici sferici (SNAS), nuove forme globulari di DNA e RNA, che aveva inventato alla Northwestern nel 1996 e che sono tossici per gli esseri umani. La sequenza di acido nucleico è progettata per abbinarsi al gene bersaglio.
E Stegh aveva il gene: nel 2007 lui e colleghi hanno identificato la sovraespressione del gene Bcl2Like12 nei tumori di glioblastoma e correlato la sovraespressione stessa, alla resistenza del glioblastoma alle terapie convenzionali.
“Il mio gruppo di ricerca sta lavorando per scoprire i segreti del cancro e, cosa più importante, per capire come fermarlo”, ha detto Stegh, co-autore senior dello studio. “Il Glioblastoma è un tumore molto impegnativo e la maggior parte dei farmaci chemio-terapeutici falliscono nella clinica. L’importanza del silenziamento del gene in questo studio è determinata dal fatto che esso svolge molti ruoli diversi nella resistenza alla terapia. L’eliminazione del gene dovrebbe consentire alle terapie convenzionali di essere più efficaci. ”
Stegh è un professore assistente presso il Ken e Ruth Davee Dipartimento di Neurologia della Northwestern University Feinberg School of Medicine e ricercatore presso l’Istituto Tumori del Cervello alla Northwestern.
La potenza della tecnologia di regolazione genica è che una malattia con una base genetica può essere attaccata e trattata se gli scienziati hanno gli strumenti giusti. Grazie al Progetto Genoma Umano e la ricerca genomica nel corso degli ultimi due decenni, vi è un enorme numero di bersagli genetici da colpire con i giusti agenti terapeutici e materiali di consegna.
E questa è stata la sfida.
” Ha detto Stegh. “Uno dei problemi è che abbiamo grandi liste di geni che sono in qualche modo disregulated nel glioblastoma, ma non abbiamo assolutamente alcun modo di colpirli tutti con approcci farmacologici standard. E’ per questo che pensiamo che i nanomateriali possono svolgere un ruolo fondamentale nel permetterci di attuare il concetto di medicina personalizzata nella terapia del cancro “.
Il nuovo farmaco per GBM è appositamente progettato per indirizzare il gene Bcl2Like12 in cellule tumorali. La chiave è la forma sferica della nanostruttura e la densità dell’acido nucleico. Normali (lineare) acidi nucleici non possono entrare nelle cellule, ma questi acidi nucleici sferici ci riescono. Piccoli RNA interferenti (siRNA) circondano il guscio di una una nanoparticella d’oro, gli acidi nucleici sono altamente orientati, densamente imballati e formano una piccola sfera. (Il nucleo di nanoparticelle d’oro è di soli 13 nanometri di diametro.) La sequenza dell’ RNA è programmata per mettere a tacere il gene della malattia.
Questo nuovo trattamento rappresenta la prima realizzazione di nanostrutture iniettate in un animale che trovano naturalmente il loro bersaglio nel cervello e possono fornire un payload di terapeutica efficace.
Il prossimo passo sarà quello di testare in studi clinici il trattamento.