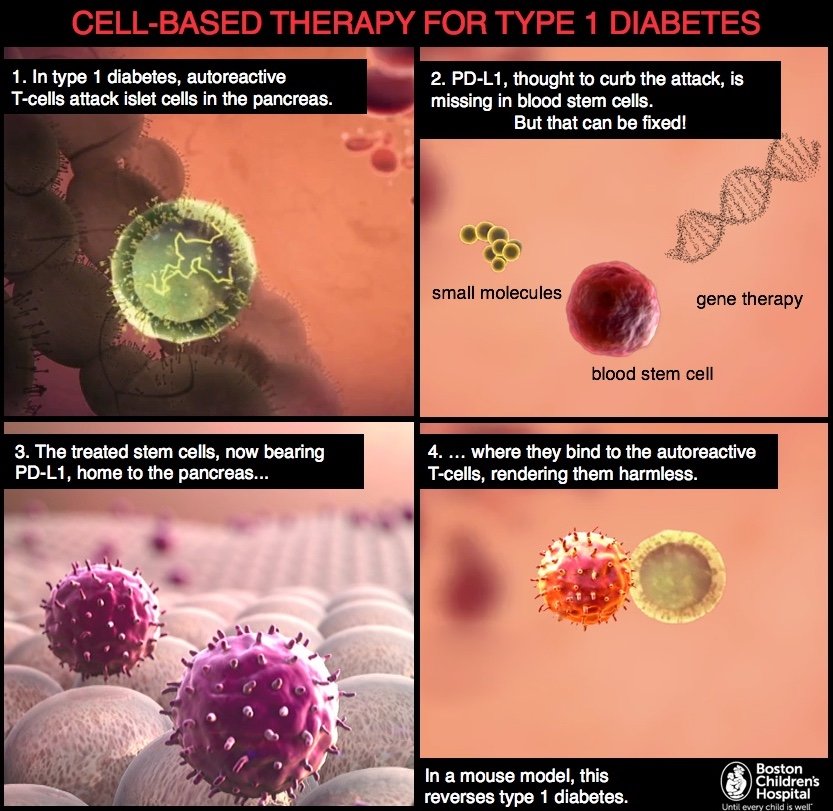
Immagine: nel diabete di tipo 1, le cellule T autoreattive attaccano le cellule insulari produttrici di insulina nel pancreas (fotogramma 1). Fiorina e colleghi hanno dimostrato che la rete di fattori regolatori genetici che controllano la produzione di una proteina chiamata PD-L1 è alterata nelle cellule staminali del sangue da topi e umani diabetici. I ricercatori hanno poi dimostrato che la produzione di PD-L1 potrebbe essere stimolata trattando le cellule staminali del sangue con la terapia genica o con piccole molecole (frame 2). Le cellule staminali trattate, ora dotate di PD-L1, raggiungono il pancreas (frame 3), dove si legano alle cellule T autoreattive, rendendole innocue (frame 4). In un modello murino, questo inverte il diabete di tipo 1. Credito: Andrea Panigada / Nancy Fliesler.
I ricercatori del Boston Children’s Hospital hanno invertito con successo il diabete di tipo 1 in un modello murino infondendo le cellule staminali del sangue pre-trattate per produrre più proteina chiamata PD-L1, che è carente nei topi (e nelle persone) con diabete di tipo 1. Le cellule staminali hanno frenato la reazione autoimmune nelle cellule di topi e umani e invertito l’iperglicemia nei topi diabetici.
I risultati dello studio sono stati pubblicati oggi su Science Translational Medicine.
“Quando si iniettano queste cellule staminali, c’è davvero una rimodellamento del sistema immunitario”, afferma Paolo Fiorina, del Boston Children’s, ricercatore senior dello studio.
Lo studio dimostra che quasi tutti i topi sono stati curati dal diabete a breve termine e un terzo ha mantenuto normali livelli di zucchero nel sangue per tutta la vita. Il trattamento è stato efficace se la produzione di PD-L1 è stata stimolata attraverso la terapia genica o il pretrattamento con piccole molecole .
I poteri di PD-L1
Precedenti studi hanno provato a utilizzare le immunoterapie per il diabete di tipo 1, con l’obiettivo di frenare l’attacco autoimmune sulle cellule delle isole di Langerhans presenti nel pancreas. Questi tentativi hanno fallito, in parte perché le terapie non hanno mirato specificamente al diabete.
“Le cellule staminali del sangue hanno capacità di regolazione immunitaria, ma sembra che nei topi e negli esseri umani con diabete queste capacità siano compromesse”, afferma Fiorina, della divisione pediatrica di nefrologia di Boston. “Abbiamo scoperto che nel diabete, le cellule staminali del sangue sono difettose, promuovono l’infiammazione e probabilmente portano alla comparsa della malattia”.
( Vedi anche:Nuova speranza per la cura del diabete di tipo 1).
Un team guidato da Fiorina e dal primo autore dello studio Moufida Ben Nasr del Boston Children’s, ha iniziato ad analizzare il trascrittoma delle cellule staminali del sangue per scoprire quali proteine producevano le cellule.
Utilizzando un microarray di espressione genica, i ricercatori hanno scoperto che la rete di fattori regolatori genetici (microRNA) che controllano la produzione di PD-L1 è alterata nelle cellule staminali del sangue da topi e umani diabetici. Questo impedisce la produzione di PD-L1, anche all’inizio della malattia.
I ricercatori hanno inoltre dimostrato che PD-L1 ha un potente effetto anti-infiammatorio nel contesto del diabete di tipo 1.
PD-L1 è conosciuta come una molecola di “checkpoint” immune. Si lega al recettore PD-1 (morte programmata inibitoria 1) sulle cellule T infiammatorie che vengono attivate per causare reazioni autoimmuni. Questo fa sì che le cellule T muoiano o diventino anergiche (o inattive).

Quando Fiorina, Ben Nasr e colleghi hanno introdotto un gene sano che codifica per PD-L1 nelle cellule staminali, utilizzando come virus un virus innocuo, le cellule trattate hanno invertito il diabete nei topi. Fiorina e colleghi hanno anche scoperto che potevano ottenere lo stesso effetto trattando le cellule con un “cocktail” di tre piccole molecole: l’interferone beta, l’interferone gamma e l’acido polinsinico-policitidilico.
“Riteniamo che la risoluzione della carenza di PD-L1 possa fornire un nuovo strumento terapeutico per il diabete”, afferma Ben Nasr.
Direzioni future
Saranno necessari ulteriori studi per determinare quanto dureranno gli effetti della terapia cellulare e quanto spesso il trattamento dovrebbe essere somministrato. “La bellezza di questo approccio è la mancanza virtuale di qualsiasi effetto negativo, dal momento che vengono usate le cellule del paziente stesso “, dice Fiorina.
In collaborazione con gli scienziati del Fate Therapeutics (San Diego, California), Fiorina e colleghi stanno lavorando per ottimizzare il “cocktail” di piccole molecole usato per modulare le cellule staminali del sangue. Il team ha completato un incontro pre-investigativo su nuovi farmaci (IND) con la Food and Drug Administration degli Stati Uniti per supportare la conduzione di una sperimentazione clinica sul diabete di tipo 1.