Fibrosi-Immagine: modello dei meccanismi MERTK per la regolazione del percorso fibrotico del core TGFβ in vari organi. Credito: Science Translational Medicine-
La scienza medica è da tempo alla ricerca di una comprensione più approfondita della devastante cicatrizzazione degli organi del corpo, nota come fibrosi, che porta alla perdita irreversibile di funzionalità.
La fibrosi si riferisce al tessuto connettivo aberrante che si accumula negli organi compromettendone la capacità di funzionare correttamente, un processo innescato da un’attività infiammatoria cronica. Questi processi infiammatori possono essere indotti da infezioni persistenti, insulti chimici o gravi lesioni tissutali. Per alcuni pazienti, la causa sottostante della loro malattia fibrotica rimane ostinatamente sfuggente. Le cicatrici fibrotiche non solo privano i pazienti della sana funzionalità degli organi, in alcuni casi rubano loro la vita.
Il tessuto cicatriziale può danneggiare uno qualsiasi degli organi principali del corpo, emergendo nei polmoni come fibrosi polmonare idiopatica o nel fegato come malattia del fegato grasso. La fibrosi renale e cardiaca sono condizioni che possono essere caratterizzate da grave compromissione degli organi. Spiegato in un altro modo, un infarto può causare l’accumulo di tessuto cicatriziale, fibrosi miocardica, ma la regione fibrotica non ha l’attività contrattile del tessuto cardiaco sano. Peggio ancora, non ci sono molte terapie che possono trattare o invertire in modo duraturo la fibrosi degli organi, rendendo la ricerca di potenziali terapie una priorità di ricerca assoluta.
Ora, i ricercatori medici in Australia stanno scoprendo nuovi indizi sulla fibrosi e su come questa condizione dannosa sia sostenuta da un ciclo di feedback positivo negli organi caratterizzati da cicatrici fibrotiche diffuse.
Isolando e definendo l’attività molecolare del ciclo di feedback, il Dott. Ziyan Pan e i colleghi del Westmead Institute for Medical Research vicino a Sydney, hanno aperto una nuova finestra sulla comprensione della fibrosi, individuando un promettente bersaglio per la terapia farmacologica.
In uno studio pubblicato su Science Translational Medicine, Pan e un team di collaboratori hanno sottolineato che isolare il ciclo di feedback positivo era fondamentale perché aiutava a spiegare la persistenza e il ruolo talvolta mortale che la fibrosi può svolgere nel danno d’organo.
“La fibrosi tissutale”, scrivono Pan e colleghi, “è alla base di molte malattie croniche difficili da curare. E mentre la citochina nota come fattore di crescita trasformante-β—TGFβ—regola la fibrosi, è anche coinvolta in altri processi biologici critici, il che la rende un obiettivo improbabile per lo sviluppo farmaceutico”.
“Il TGFβ stimola la fibrosi e la progressione della malattia in numerose patologie croniche, ma colpire questa citochina ubiquitariamente espressa potrebbe non produrre una terapia antifibrotica valida e sicura“, scrive Pan sulla rivista.
“Abbiamo cercato di identificare metodi alternativi per inibire la segnalazione TGFβ utilizzando cellule stellate epatiche umane e macrofagi provenienti da esseri umani e topi in vitro, nonché modelli murini di fibrosi epatica, renale e polmonare“, ha continuato Pan.
Dato che il TGFβ è problematico come potenziale bersaglio farmacologico, Pan e colleghi ne hanno scovato uno diverso, più duraturo. Durante il loro studio sui modelli murini di fibrosi epatica, renale e polmonare, i ricercatori hanno scoperto che gli organi mostravano livelli molto elevati di un enzima noto come MERTK.
Hanno anche scoperto che i campioni di biopsia epatica di pazienti affetti da steatosi epatica fibrotica contenevano livelli elevati di MERTK, in particolare i campioni di pazienti con stadi notevolmente avanzati di fibrosi.
Ciò che il team ha fatto in seguito ha gettato le basi per una potenziale strategia di trattamento contro la fibrosi, indipendentemente dall’organo colpito dalla malattia.
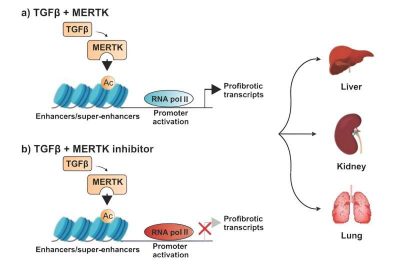
Tornando ai modelli murini di fibrosi epatica, renale e polmonare, Pan e gli altri scienziati hanno scoperto che MERTK induceva anche l’espressione di TGFβ e guidava la segnalazione di TGFβ, con conseguente ciclo di feedback positivo che promuoveva la fibrosi nelle cellule coltivate. Come parte del loro studio, i ricercatori hanno trovato un modo per smussare MERT, fermando la segnalazione di TGFβ e il processo in corso di fibrosi.
“MERTK ha aumentato la trascrizione dei geni che regolano la fibrosi modulando l’accessibilità della cromatina e l’attività della RNA polimerasi II“, ha scritto Pan. “In ciascuno dei tre modelli di topi, l’interruzione del ciclo di segnalazione che promuove la fibrosi riducendo l’espressione di MERTK, ha ridotto la fibrosi degli organi”.
Gli scienziati hanno introdotto un farmaco sperimentale nelle cellule fibrotiche, un inibitore MERTK chiamato UNC569. Il farmaco sperimentale ha ridotto la fibrosi nel fegato, nei reni e nei polmoni dei modelli di topi quando somministrato all’inizio del processo della malattia. Con sorpresa di Pan e del team di scienziati, il farmaco sperimentale ha anche invertito la fibrosi epatica quando somministrato a topi con danni epatici accertati.
“L’inibizione farmacologica di MERTK ha ridotto la fibrosi in questi modelli di topi, sia quando è stata avviata immediatamente dopo la lesione, sia quando è stata avviata dopo che la fibrosi era stata stabilita“, ha affermato Pan. “Insieme, questi dati suggeriscono che MERTK svolge un ruolo nella modulazione della fibrosi degli organi e potrebbe essere un potenziale bersaglio per il trattamento di malattie fibrotiche“.
Se l‘inibitore sperimentale MERTK noto come UNC569 diventerà un farmaco per la sperimentazione umana è una questione che deve ancora essere affrontata. Pan e colleghi hanno dimostrato, cosa più importante, che la fibrosi è sostenuta nei tessuti dallo stesso ciclo di feedback positivo e che il ciclo può essere interrotto farmaceuticamente.
Leggi anche:Acidi grassi omega 3 possono rallentare la fibrosi polmonare
“Questi risultati ampliano la nostra comprensione del ruolo del MERTK, ma rivelano anche nuove molecole regolatrici che regolano l’attività del TGF-β durante la fibrosi”, ha concluso Pan.
Fonte:Science Translational Medicine