Ferite croniche-Immagine: astratto grafico. Credito Cell Chemical Biology.
Le ferite croniche sono piaghe aperte o tessuti lesi che non riescono a guarire correttamente. Questi tipi di ferite sono notoriamente difficili da trattare a causa di infezioni batteriche come Staphylococcus aureus o S. aureus. Inoltre, le infezioni batteriche altamente resistenti agli antibiotici, come lo S. aureus resistente alla meticillina (MRSA), sono una delle principali cause di infezioni potenzialmente letali nei pazienti ospedalieri.
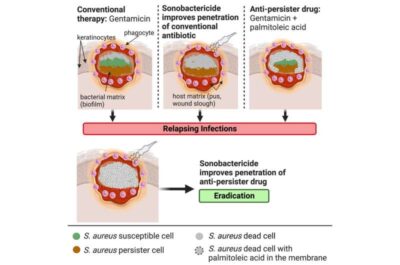
Per difendersi dal nostro sistema immunitario e da altre minacce, S. aureus può unirsi, creando un campo di forza scivoloso e viscido, o biofilm, attorno a sé. La barriera del biofilm è così spessa che né le cellule immunitarie né gli antibiotici possono penetrare e neutralizzare i batteri nocivi.
I ricercatori della UNC School of Medicine e del UNC-NC State Joint Department of Biomedical Engineering hanno sviluppato un nuovo metodo che combina acido palmitoleico, gentamicina e ultrasuoni non invasivi per aiutare a migliorare la somministrazione di farmaci nelle ferite croniche che sono state infettate da S. aureola.
Usando la loro nuova strategia, i ricercatori sono stati in grado di ridurre del 94% l’impegnativa infezione da MRSA nelle ferite dei topi diabetici. Sono stati in grado di sterilizzare completamente le ferite in molti dei topi e il resto aveva una carica batterica significativamente ridotta.
I loro risultati sono stati pubblicati su Cell Chemical Biology.
“Quando i batteri non vengono completamente eliminati dalle ferite croniche, il paziente è ad alto rischio di infezione ricorrente o di sviluppare un’infezione secondaria“, ha affermato l’autrice senior dello studio Sarah Rowe-Conlon, Ph.D., Professore associato di ricerca presso il Dipartimento di Microbiologia e Immunologia. “Questa strategia terapeutica ha il potenziale per migliorare i risultati e ridurre le recidive di infezioni croniche della ferita nei pazienti. Siamo entusiasti del potenziale di tradurla in clinica, ed è quello che stiamo esplorando in questo momento“.
I biofilm fungono da barriera fisica a molte classi di antibiotici. Virginie Papadopoulou, Ph.D., Prof.ssa assistente di ricerca presso il Dipartimento congiunto UNC-NCSU di ingegneria biomedica, era curiosa di sapere se gli ultrasuoni potenziati dalla cavitazione non invasivi potessero creare abbastanza agitazione da formare spazi aperti nel biofilm per facilitare la consegna del farmaco.
Goccioline liquide che possono essere attivate dagli ultrasuoni, chiamate agente di contrasto a cambiamento di fase (PCCA), vengono applicate localmente sulla ferita. Un trasduttore a ultrasuoni viene focalizzato sulla ferita e acceso, provocando l’espansione del liquido all’interno delle goccioline e la trasformazione in microscopiche microbolle piene di gas, che poi si muovono rapidamente.
L’oscillazione di queste microbolle agita il biofilm, interrompendolo meccanicamente e aumentando il flusso del fluido. In definitiva, la combinazione della rottura del biofilm e della maggiore permeazione dei farmaci attraverso il biofilm ha permesso ai farmaci di entrare e uccidere il biofilm batterico con un’efficienza molto elevata.
Vedi anche:Scoperta rivoluzionaria per il trattamento delle ferite croniche
“Le microbolle e gli agenti di contrasto a cambiamento di fase agiscono come amplificatori locali dell’energia degli ultrasuoni, consentendoci di colpire con precisione le ferite e le aree del corpo per ottenere risultati terapeutici non possibili con gli ultrasuoni standard“, ha affermato Dayton, William R. Kenan Jr. Distinguished Professor e Direttore di Dipartimento del Dipartimento congiunto UNC-NCSU di Ingegneria Biomedica. “Speriamo di poter utilizzare tecnologie simili per la somministrazione locale di chemioterapici a tumori ostinati o per guidare nuovo materiale genetico anche nelle cellule danneggiate“.
Quando le cellule batteriche sono intrappolate all’interno del biofilm, hanno scarso accesso ai nutrienti e all’ossigeno. Per conservare le loro risorse ed energia, passano a uno stato dormiente o assonnato. I batteri, noti come cellule persistenti in questo stato, sono estremamente resistenti agli antibiotici.
I ricercatori hanno scelto la Gentamicina, un antibiotico topico inefficace contro S. aureus a causa della diffusa resistenza agli antibiotici e della scarsa attività contro le cellule persistenti. I ricercatori hanno anche introdotto nei loro modelli un nuovo antibiotico adiuvante, l’acido palmitoleico.
L’acido palmitoleico, un acido grasso insaturo, è un prodotto naturale del corpo umano che ha forti proprietà antibatteriche. L’acido grasso si incorpora nella membrana delle cellule batteriche e gli autori hanno scoperto che facilita l’ingresso riuscito dell’antibiotico nelle cellule di S. aureus ed è in grado di uccidere le cellule persistenti e invertire la resistenza agli antibiotici.
Nel complesso, il team è entusiasta del nuovo approccio topico e non invasivo perché potrebbe fornire a scienziati e medici più strumenti per combattere la resistenza agli antibiotici e ridurre i gravi effetti avversi dell’assunzione di antibiotici per via orale.
“Gli antibiotici sistemici, come quelli orali o IV, funzionano molto bene, ma spesso c’è un grande rischio ad essi associato come la tossicità, l’eliminazione della microflora intestinale e l’infezione da C. difficile“, ha affermato Rowe-Conlon. “Utilizzando questo sistema, siamo in grado di far funzionare i farmaci topici e possono essere applicati al sito di infezione a concentrazioni molto elevate, senza i rischi associati alla somministrazione sistemica“.
Fonte: Cell Chemical Biology