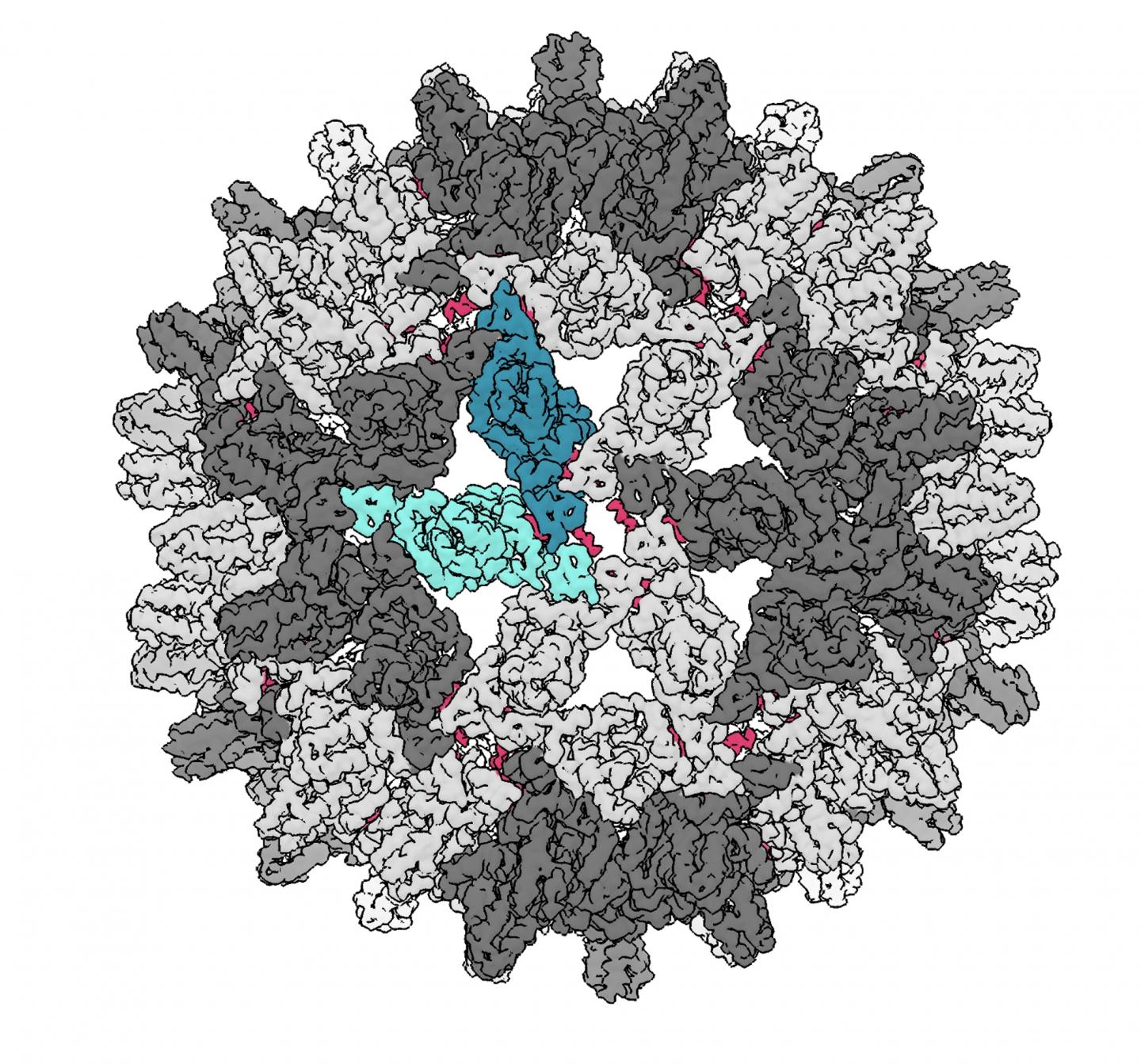
Immagine: questa immagine mostra il guscio, o capside, che incapsula il DNA del virus dell’epatite B che è composto da 240 copie della stessa proteina. Le aree verdi rappresentano le regioni strutturalmente uniche che si trovano in una disposizione ripetuta sulla superficie del guscio. Le piccole aree rosse rivelano i siti in cui la molecola HAP si lega al virus. Credit: immagine gentilmente concessa da Christopher Schlicksup, Indiana University.
I ricercatori dell’Università dell’Indiana hanno compiuto un importante passo avanti nella progettazione di farmaci che combattono il virus dell’epatite B che può causare insufficienza epatica e cancro al fegato.
Si stima che 2 miliardi di persone in tutto il mondo abbiano avuto un’infezione da virus dell’epatite B nel corso della loro vita, con circa 250 milioni – compresi 2 milioni di americani – che vivono con un’infezione cronica. Sebbene esista un vaccino, non esiste una cura per la malattia.
Lo studio, pubblicato il 29 gennaio sulla rivista eLife, spiega come la struttura del virus dell’epatite B cambia quando associata a un farmaco sperimentale. I membri di questa nuova classe di farmaci antivirali sono ora sottoposti a studi clinici.
( Vedi anche: L’ aspirina può ridurre il rischio di cancro al fegato nei pazienti con epatite B).
“La nostra scoperta suggerisce che questo stesso farmaco potrebbe attaccare il virus dell’epatite B su più fronti, impedendo la replicazione e uccidendo nuove copie del virus”, ha detto l’autore senior dello studio Adam Zlotnick, Professore presso l’Università di Bloomington della IU, Dip. di biochimica molecolare e cellulare. “Possiamo sfruttare i molteplici modi in cui questo farmaco può funzionare nello stesso tempo”.
La ricerca è stata guidata da Christopher Schlicksup, uno studente laureato nel Dipartimento di biochimica molecolare e cellulare dell’ l’Università di Bloomington della IU.
Un virus si riproduce dirottando il macchinario cellulare di un ospite. La maggior parte dei virus protegge il proprio materiale genetico – DNA o RNA – all’interno di un guscio proteico chiamato “capside”.
Negli ultimi 20 anni, il laboratorio di Zlotnick ha condotto ricerche per fermare le infezioni virali studiando la fisica dei virus e concentrandosi su come si forma il capside.
“La reazione è un po’ come lanciare un mazzo di carte nell’aria per costruire il Taj Mahal – una struttura altamente complessa che sembra emergere dal caos”, ha detto Zlotnick. Il suo lavoro ha aiutato a scoprire una classe di molecole chiamate modulatori allosterici proteici core, o CpAM che interrompono l’assemblaggio della proteina capside.
Le molecole CpAM attaccano i virus causando la rotture del guscio proteico e interrompendo il ciclo di vita del virus. In precedenza, queste molecole CpAM erano viste come capaci solo di interrompere un virus durante la formazione del capside, dopodiché il suo DNA era protetto all’interno di un involucro rigido.
Questo nuovo studio rileva che la molecola può rompere questo guscio anche dopo che è già stato assemblato.
Per la scoperta, gli scienziati dell’IU hanno legato la molecola CpAM a una sostanza chimica chiamata TAMRA – una tintura color cremisi usata in un rossetto rosso – per renderla fluorescente e più facile da rilevare negli esperimenti. Usando la microscopia crioelettronica, i ricercatori hanno scoperto che la piccola molecola CpAM poteva far piegare e deformare il capside del virus, simile a un pallone da calcio.
“La grande implicazione di questa scoperta è che i capside virali non sono così impenetrabili come si pensava in precedenza“, ha detto Zlotnick. “L’altra implicazione, che può essere ancora più importante, è che se questo tipo di interferenza funziona contro il virus dell’epatite B, potrebbe funzionare anche contro altri virus. Circa la metà delle famiglie di virus conosciuti ha capsidi simili a un pallone da calcio, tra cui la polio e l’herpes”, ha aggiunto il ricercatore. “Questo studio può portare a trattamenti migliori contro i virus dal momento che i meccanismi alla base della rottura del capside potrebbero portare a nuovi farmaci contro i virus”.
Zlotnick è anche il co-fondatore di Assembly Biosciences, una società quotata al NASDAQ, che sta studiando le molecole CpAMs in studi clinici. Sebbene la molecola utilizzata in questo studio non sia una delle molecole sotto sperimentazione clinica, Zlotnick sostiene che il meccanismo scoperto fa luce sul comportamento dei farmaci sperimentali. Successivamente, Zlotnick spera di condurre studi simili sui CpAMs in sperimentazione clinica.
Fonte:eLife