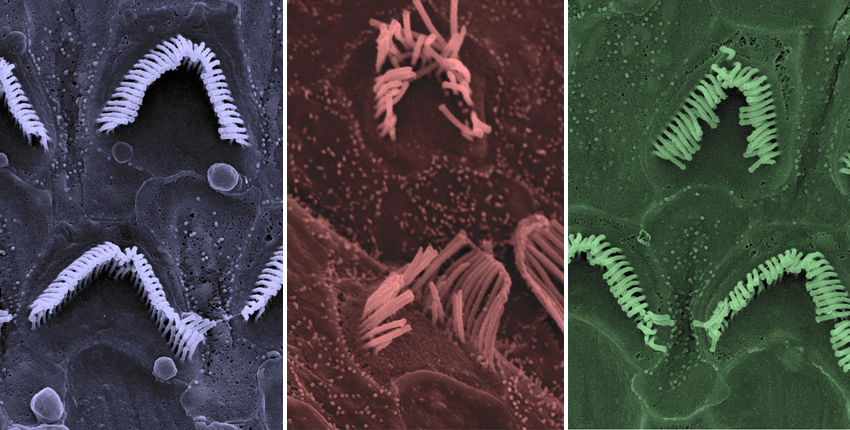
Immagine, da sinistra: cellule ciliate normali, cellule ciliate non trattate di topi Beethoven, cellule ciliate trattate di topi Beethoven. Immagine: Carl Nist-Lund e Jeffrey Holt
Gli scienziati della Harvard Medical School e dell’ Ospedale pediatrico di Boston hanno utilizzato un nuovo approccio di editing genetico per salvare l’udito dei topi con perdita dell’udito genetica e sono riusciti a farlo senza alcun apparente effetto off-target a seguito del trattamento.
Gli animali, noti come topi di Beethoven (anche Beethoven era diventato sordo), sono stati trattati per la stessa mutazione genetica che causa una progressiva perdita dell’udito nell’uomo, culminando in una profonda sordità verso la metà dei 20 anni.
Il nuovo approccio, descritto online il 3 luglio in Nature Medicine, prevede una versione ottimizzata e più precisa del classico sistema di editing genetico CRISPR-Cas9 che è migliore nel riconoscere la mutazione patogena osservata nei topi di Beethoven. Lo strumento raffinato ha permesso agli scienziati di disabilitare selettivamente la copia difettosa di un gene uditivo chiamato Tmc1, risparmiando nel contempo la copia sana.
In particolare, secondo i ricercatori, il loro sistema è riuscito a riconoscere una singola lettera di DNA errata nella copia difettosa tra 3 miliardi di lettere nel genoma del topo.
“Ancora molto lavoro resta da fare prima che una terapia di editing genetico altamente precisa come questa possa essere utilizzata nell’uomo”, avvertoni i ricercatori. ” Tuttavia”, hanno affermato, ” il lavoro rappresenta una pietra miliare perché migliora notevolmente l’efficacia e la sicurezza delle tecniche standard di modifica genetica”.
“I nostri risultati dimostrano che questa versione più raffinata e mirata dell’ormai classico strumento di editing CRISPR / Cas9 raggiunge un livello senza precedenti di identificazione e accuratezza”, ha affermato David Corey, Professore di scienze mediche traslazionali di Bertarelli nell’ Istituto Blavatnik presso la Harvard Medical School.
Inoltre, il team ha affermato che i risultati dello studio hanno posto le basi per l’utilizzo dello stesso approccio di precisione per il trattamento di altre malattie genetiche ereditarie dominanti che derivano da una singola copia difettosa di un gene.
Ognuno eredita due copie dello stesso gene, una per ciascun genitore. In molti casi, un gene normale è sufficiente per garantire la normale funzione che risparmia l’individuo dalla malattia. Al contrario, nei cosiddetti disturbi genetici ereditati in modo dominante, una singola copia difettosa può causare malattie.
“Riteniamo che il nostro lavoro apra le porte a un modo iper-mirato per trattare una serie di disturbi genetici che derivano da una copia difettosa di un gene“, ha dichiarato il ricercatore Jeffrey Holt, Professore di otorinolaringoiatria e neurologia presso la Harvard Medical School presso Boston Children’s Hospital, che è anche affiliato alla FM Kirby Neurobiology Center presso Boston Children’s. “Questa è veramente la medicina di precisione.“
I topi che trasportano il gene Tmc1 difettoso sono noti come topi di Beethoven perché il decorso della loro malattia imita la progressiva perdita dell’udito sperimentata dal famoso compositore.
Nei topi, il difetto di Beethoven è contrassegnato da una lettera errata nella sequenza del DNA del gene Tmc1 – una A anziché una T – un singolo errore che indica la differenza tra udito normale e sordità.
Disabilitare o mettere a tacere la copia mutante di Tmc1 gene sarebbe sufficiente per preservare l’udito dell’animale, ma come si potrebbe fare senza disabilitare inavvertitamente anche il gene sano?
Due chiavi sono meglio di una
I classici sistemi di editing genico CRISPR-Cas9 funzionano utilizzando una molecola guida – gRNA – per identificare la sequenza di DNA mutante bersaglio. Una volta individuato il DNA target, l’enzima di taglio – Cas9 – lo taglia. Finora, questi editor di geni hanno mostrato un’accuratezza tutt’altro che perfetta. Questo perché l’RNA guida che porta l’enzima Cas9 al sito bersaglio e l’enzima Cas9 che taglia il DNA bersaglio non sono del tutto precisi e potrebbero finire col tagliare il DNA sbagliato.
Per vincere queste sfide, i ricercatori hanno adattato uno strumento originariamente sviluppato da Keith Joung, Professore di patologia HMS e Ben Kleinstiver e assistente Professore di patologia HMS, presso il Massachusetts General Hospital, che utilizza un enzima Cas9 modificato derivato dallo Staphylococcus aureus invece dello standard Cas9 che deriva dal batterio Streptococcus pyogenes.
Per ottenere una maggiore accuratezza del rilevamento e dell’interruzione, il nuovo sistema ottimizzato combina due livelli di riconoscimento: gRNA per localizzare il gene bersaglio e una forma modificata di Cas9 che può individuare la specifica mutazione del DNA nei topi di Beethoven. L’uso di due forme di identificazione garantisce il taglio preciso e selettivo della copia aberrante – e solo della copia aberrante – di quel gene.
“Abbiamo approfittato del fatto che questo sistema riconosce il DNA mutante, ma non il DNA normale e utilizza un doppio sistema di riconoscimento per una maggiore precisione“, ha detto il primo autore dello studio Bence György, che ha condotto il lavoro mentre era alla Harvard Medical School ed è ora all’Istituto di oftalmologia molecolare e clinica a Basilea, Svizzera. “Questo approccio ha portato a un livello di specificità senza precedenti nel prendere di mira il gene mutante”.
In una serie iniziale di esperimenti in cellule con e senza la mutazione di Beethoven, lo strumento ha accuratamente distinto il DNA mutante e il DNA normale in copie del gene Tmc1. Ulteriori analisi hanno rivelato che nelle cellule di Beethoven, che contenevano una copia difettosa e una normale del gene, almeno il 99 percento dei “tagli” molecolari avveniva esclusivamente nella copia difettosa del gene.
Successivamente, i ricercatori hanno iniettato il trattamento di modifica genetica nelle orecchie interne dei topi con e senza la mutazione di Beethoven. L’analisi del DNA ha mostrato che l’attività di editing si è verificata solo nelle cellule dell’orecchio interno dei topi con il difetto di Beethoven. Non sono stati rilevati cambiamenti di modifica nelle cellule delle orecchie interne dei topi trattati che non presentavano la mutazione, un risultato che ha confermato la precisione dello strumento.
Per determinare se la terapia di modifica genetica ha interferito con la normale funzione genica, gli scienziati hanno stimolato le cellule uditive, chiamate cellule ciliate, delle orecchie interne dei topi trattati che non presentavano il difetto di Beethoven. Le cellule hanno mostrato risposte uditive normali e invariate, confermando che la terapia di modifica genetica non ha avuto alcun effetto sulla normale funzione genica
Silenziare Beethoven
Per misurare se la terapia ha funzionato negli animali piuttosto che nelle sole cellule, i ricercatori hanno eseguito il test standard per l’udito. Hanno misurato le risposte uditive del tronco cerebrale degli animali, che catturano la quantità di suono rilevata dalle cellule ciliate nell’orecchio interno e trasmessa al cervello.
Senza trattamento, i topi Beethoven sono in genere completamente sordi entro i 6 mesi di età. In confronto, i topi senza difetto genetico mantengono l’udito normale per tutta la vita e possono rilevare suoni a circa 30 decibel, un livello simile a un sussurro.
Due mesi dopo aver ricevuto la terapia di modifica genetica, i topi di Beethoven hanno mostrato un udito nettamente migliore rispetto ai fratelli non trattati che trasportavano la mutazione genetica. Gli animali trattati erano in grado di rilevare suoni a circa 45 decibel – il livello di una normale conversazione – o circa 16 volte più silenziosi dei topi non trattati. Il topo Beethoven era in grado di udire suoni da 25 a 30 decibel, praticamente indistinguibile dai suoi pari sani.
Nel loro insieme, i risultati dimostrano che la nuova terapia genica ha efficacemente messo a tacere la copia difettosa del gene e recuperato l’udito degli animali dalla rapida perdita tipica della malattia.
Poiché la malattia è caratterizzata da una progressiva perdita dell’udito, i ricercatori hanno valutato l’effetto della terapia sulla progressione per diversi mesi. I ricercatori hanno somministrato il trattamento poco dopo la nascita e hanno testato i livelli di udito nei topi trattati e non trattati con e senza la mutazione ogni quattro settimane per un massimo di sei mesi. Nel primo mese, i topi Beethoven non trattati potevano sentire suoni a bassa frequenza, ma avevano una notevole perdita dell’udito alle alte frequenze. Al sesto mese dopo la nascita, i topi Beethoven non trattati avevano perso tutto il loro udito. Al contrario, i topi Beethoven trattati hanno mantenuto un udito quasi normale alle basse frequenze, con alcuni che hanno mostrato un udito quasi normale anche alle alte frequenze.
In particolare, gli animali trattati che non presentavano il difetto genetico non hanno sperimentato alcuna perdita dell’udito a seguito della terapia genica, una scoperta che ha dimostrato la sicurezza della procedura e la sua capacità di colpire selettivamente la copia aberrante del gene. Ancora più incoraggiante, un piccolo sottogruppo di topi Beethoven trattati che sono stati seguiti per quasi un anno ha mantenuto un udito stabile, quasi normale.
Il difetto di Beethoven è caratterizzato dal progressivo deterioramento e morte delle cellule uditive nell’orecchio interno. I ricercatori hanno utilizzato la microscopia elettronica per visualizzare la struttura di queste cellule uditive critiche. Come previsto, nei topi Beethoven non trattati, i ricercatori hanno visto una graduale perdita di cellule uditive insieme a un deterioramento della loro struttura. Al contrario, i topi Beethoven trattati e i topi sani trattati hanno entrambi mantenuto un numero normale di cellule uditive con struttura intatta o quasi intatta.
Lo strumento di editing genico ottimizzato previene la perdita dell’udito nei topi con sordità ereditaria senza effetti rilevabili fuori bersaglio.
Fonte, Harvard.edu