A seguito di lesioni del midollo spinale, la maggior parte dei pazienti sperimentano una esagerazione del tono muscolare chiamata spasticità, che porta spesso a disabilità fisica.
Un team dell’ Institut de Neurosciences de la Timone (CNRS / Aix-Marseille Université) ha appena individuato uno dei meccanismi molecolari responsabili di questo fenomeno. Ha anche proposto due soluzioni terapeutiche che si sono dimostrate efficaci negli animali, una delle quali sarà testata in studi clinici di fase II, quest’anno.
Questo lavoro, pubblicato su Nature Medicine il 14 marzo 2016, apre nuove prospettive terapeutiche per ridurre questa disabilità fisica.
Dodici milioni di persone in tutto il mondo soffrono di un disturbo chiamato spasticità che si verifica a seguito di una lesione del midollo spinale (incidenti stradali, ictus) o nel contesto di malattie neurodegenerative come la sclerosi laterale amiotrofica (o malattia di Lou Gehrig). Il disturbo è caratterizzato principalmente da una ipereccitabilità dei motoneuroni, i neuroni del midollo spinale che controllano le nostre contrazioni muscolari.Questa ipereccitabilità porta a contrazioni simultanee e incontrollate dei muscoli flessori ed estensori, rendendo ogni movimento motorio difficile o addirittura impossibile e i trattamenti attualmente disponibili, non sono soddisfacenti.
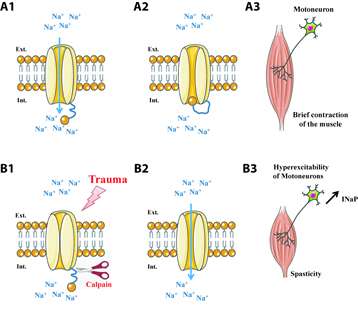
La eccitabilità dei neuroni è parzialmente attivata dai canali di sodio espressi sulla loro membrana. La loro apertura genera un ingresso di sodio che causa la breve attivazione dei motoneuroni, causando una breve contrazione muscolare (Figura A1). Nel caso di spasticità, queste correnti di sodio durano più a lungo e sono descritte come “permanenti”, provocando la ipereccitabilità dei neuroni. Il team guidato da Frédéric Brocard dell’ Institut de Neurosciences de la Timone, ha scoperto che i risultati di questa ipereccitabilità sono causati dalla deregolamentazione dei canali del sodio del neurone.
La inibizione dei canali di sodio consente il controllo dell’eccitabilità dei motoneuroni. Gli scienziati hanno dimostrato che a seguito di una lesione del midollo spinale, l’attività di un enzima, la calpaina, è sottoregolata. Questo enzima inibisce i canali del sodio, rendendo il processo di inattivazione inutilizzabile (figura B1). Il poro rimane quindi aperto, generando una corrente di sodio prolungata e persistente (figure B2 e B3).

Visualizzazione di un motoneurone fluorescente nel midollo spinale. Credit: Frédéric Brocard
Il team di ricerca ha testato due trattamenti nei ratti affetti da lesioni del midollo spinale. Una delle molecole era un inibitore calpain. Il suo utilizzo nel corso di un breve periodo (dieci giorni) ha ripristinato il corretto funzionamento del canale del sodio e ridotto il grado di spasticità. Un mese dopo la fine del trattamento, gli effetti positivi sulla spasticità erano persistenti.
L’altra molecola testata, riluzolo, agisce come un inibitore della persistenza della corrente di sodio. Riduce anche la spasticità, sebbene i suoi effetti siano temporanei, in quanto il disturbo è riapparso due settimane dopo la fine del trattamento. La molecola è comunque di notevole interesse perché può già essere somministrata a pazienti con malattia di Lou Gehrig. Studi clinici di fase II sono in programma per l’inizio di anno a Hôpital de la Timone (Marsiglia, Francia) per dimostrare l’efficacia delle molecole nel trattamento della spasticità in pazienti con lesioni del midollo spinale. In parallelo, la squadra di Frédéric Brocard continuerà a decifrare il fenomeno della spasticità – o più specificamente il coinvolgimento della calpaina nella deregolamentazione dei motoneuroni – e a testare altri inibitori di questo enzima che possono essere somministrati agli esseri umani.
Fonte: Nature