Immagine: SARS-CoV-2. Public Domain.
Esperimenti condotti da ricercatori presso l’Oak Ridge National Laboratory del Dipartimento dell’Energia hanno determinato che diversi farmaci per l’epatite C possono inibire la proteasi principale SARS-CoV-2, un enzima proteico cruciale che consente al nuovo coronavirus di riprodursi.
Inibire o bloccare il funzionamento di questa proteasi è fondamentale per impedire la diffusione del virus nei pazienti con COVID-19. Lo studio, pubblicato sulla rivista Structure, fa parte degli sforzi per sviluppare rapidamente trattamenti farmaceutici per COVID-19 riutilizzando farmaci esistenti noti per trattare efficacemente altre malattie virali.
“Attualmente, non ci sono inibitori approvati dalla Food and Drug Administration che prendono di mira la proteasi principale SARS-CoV-2”, ha detto l’autore principale di ORNL Daniel Kneller. “Quello che abbiamo scoperto è che i farmaci per l’epatite C si legano e inibiscono la proteasi del coronavirus. Questo è un primo passo importante per determinare se questi farmaci debbano essere considerati potenziali candidati riproposti per il trattamento della COVID-19“.
Il coronavirus SARS-CoV-2 si diffonde esprimendo lunghe catene di poliproteine che devono essere tagliate dalla proteasi principale per diventare proteine funzionali, rendendo la proteasi un importante bersaglio farmacologico per ricercatori e sviluppatori di farmaci.
Nello studio, il team ha esaminato diverse molecole di farmaci ben note per potenziali sforzi di riproposizione tra cui la leupeptina, un inibitore della proteasi naturale e tre inibitori della proteasi dell’epatite C approvati dalla FDA: Telaprevir, Narlaprevir e Boceprevir.
Il team ha eseguito misurazioni a raggi X a temperatura ambiente per costruire una mappa tridimensionale che ha rivelato come erano disposti gli atomi e dove si sono formati i legami chimici tra la proteasi e gli inibitori farmacologici.
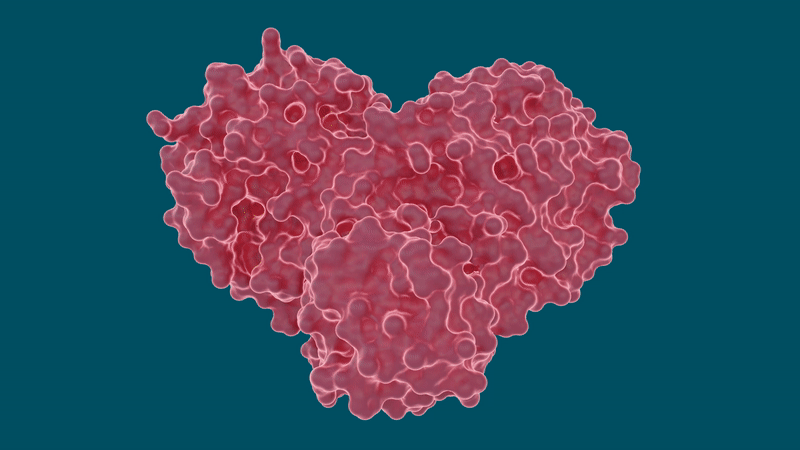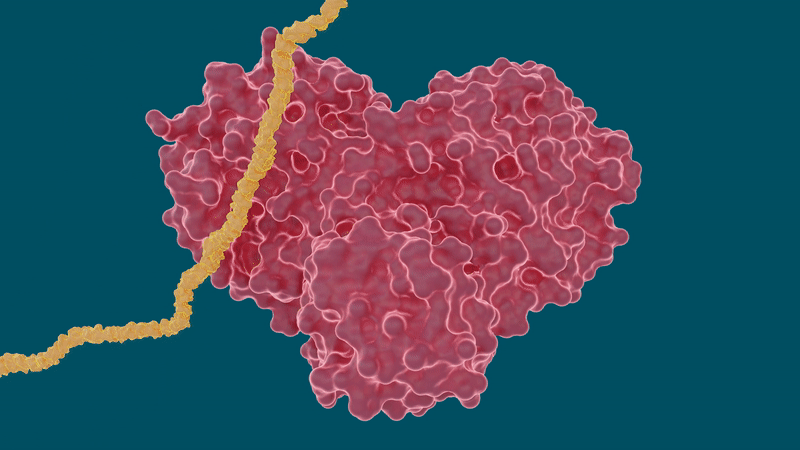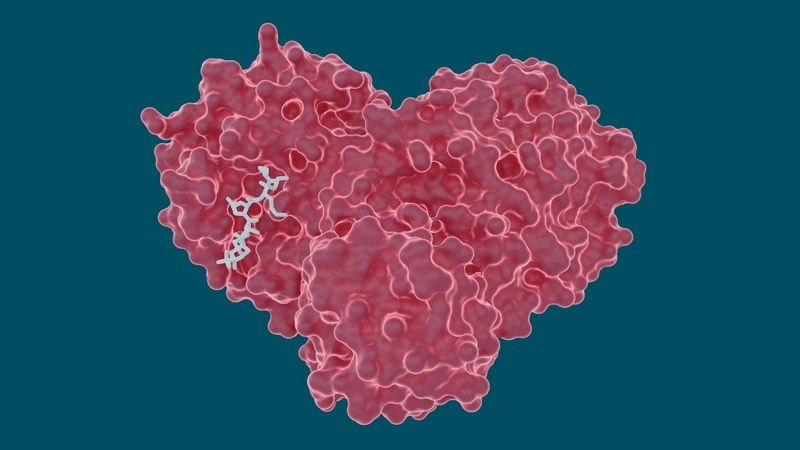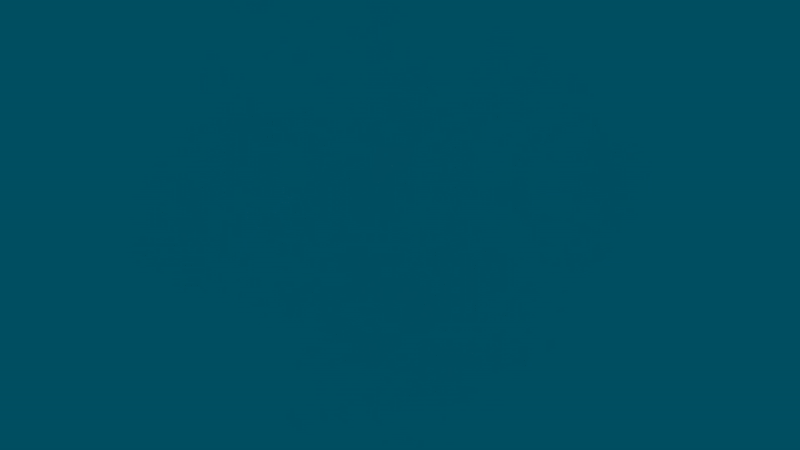
Gli esperimenti hanno prodotto risultati promettenti per alcuni farmaci per l’epatite C nella loro capacità di legare e inibire la proteasi principale SARS-CoV-2, in particolare Boceprevir e Narlaprevir. La leupeptina ha mostrato una bassa affinità di legame ed è stata esclusa come possibile candidato.
Per capire meglio quanto bene o quanto strettamente gli inibitori si legano alla proteasi, i ricercatori hanno utilizzato la cinetica enzimatica in vitro, una tecnica che consente ai ricercatori di studiare la proteasi e l’inibitore in una provetta per misurare l’affinità di legame dell’inibitore, o compatibilità, con il proteasi. Maggiore è l’affinità di legame, più efficace è l’inibitore nel bloccare il funzionamento della proteasi.
“Quello che stiamo facendo è gettare le basi molecolari per questi potenziali inibitori della riconversione dei farmaci rivelando la loro modalità d’azione”, ha detto l’autore corrispondente dell’ORNL Andrey Kovalevsky. “Mostriamo a livello molecolare come si legano, dove si legano e cosa stanno facendo alla forma dell’enzima. E, con la cinetica in vitro, sappiamo anche quanto bene si legano. Ogni informazione ci avvicina di un passo a capire come fermare il virus”.
Lo studio fa anche luce su un comportamento peculiare della capacità della proteasi di cambiare o adattare la sua forma in base alle dimensioni e alla struttura della molecola inibitrice a cui si lega. Le tasche all’interno della proteasi in cui si attaccherebbe una molecola di farmaco sono altamente malleabili o flessibili e possono aprirsi o chiudersi in una misura a seconda delle dimensioni delle molecole del farmaco.
Prima della pubblicazione del documento, i ricercatori hanno reso i loro dati pubblicamente disponibili per informare e assistere le comunità scientifiche e mediche. Sono necessarie ulteriori ricerche, inclusi studi clinici, per convalidare l’efficacia e la sicurezza dei farmaci come trattamento COVID-19.
“La ricerca suggerisce che vale la pena considerare gli inibitori dell’epatite C come potenziali candidati riproposti. Il rilascio immediato dei nostri dati consente alla comunità scientifica di iniziare a guardare le interazioni tra questi inibitori e la proteasi”, ha detto l’autore corrispondente dell’ORNL Leighton Coates. “Non è possibile progettare un farmaco senza sapere come funziona a livello molecolare e i dati che forniamo sono esattamente ciò di cui gli sviluppatori hanno bisogno per progettare farmaci più forti e più strettamente vincolanti per trattamenti più efficaci”.
Fonte:Cell