Distrofia di Duchenne-Immagine Ctredit Public Domain-
La decisione della FDA, prevista per questo mese, fa seguito a diversi contrattempi e ritardi e porrà scelte difficili per le famiglie dei bambini con distrofia muscolare di Duchenne.
La strada verso le terapie geniche per le malattie genetiche è stata lunga e costosa, ma il campo potrebbe presto ricevere buone notizie. Il 22 giugno la Food and Drug Administration degli Stati Uniti deciderà se concedere un’approvazione accelerata alla prima terapia genica per la distrofia muscolare di Duchenne (DMD), una malattia genetica che colpisce circa 1 ragazzo su 3.500. I bambini con DMD non possono produrre una proteina chiamata distrofina, con conseguente progressiva degenerazione muscolare e morte intorno ai vent’anni a causa di insufficienza cardiaca o respiratoria.
La terapia, nota come SRP-9001, è prodotta da Sarepta Therapeutics con sede a Cambridge, Massachusetts. Sarebbe la tredicesima terapia genica approvata dalla FDA dal 2017 e la prima a colpire una malattia genetica prevalente nei bambini. L’approvazione accelerata consentirebbe al farmaco di raggiungere il mercato prima del completamento di ampi studi clinici, sulla base dell’evidenza che la terapia consente ai ragazzi di produrre una forma ingegnerizzata di distrofina.
La data della decisione è stata posticipata alla fine di maggio dopo che i funzionari e i consulenti della FDA hanno sollevato preoccupazioni sulla solidità dei dati di Sarepta ottenuti finora; SRP-9001 sembra avere solo un effetto modesto sulla funzione muscolare e solo in alcune persone. Un comunicato stampa della società afferma che è probabile che l’Agenzia lo approvi solo per i ragazzi di quattro e cinque anni, ma potrebbe ampliare tale intervallo se uno studio clinico in corso dimostrerà che l’efficacia del farmaco vale i rischi ad esso associati. Gli analisti prevedono che il trattamento una tantum costerà 2 milioni di dollari. Un portavoce di Sarepta ha rifiutato di rivelare il prezzo fino a quando il farmaco non sarà approvato, ma afferma che avrà un prezzo “inferiore al valore che porterà ai pazienti”.
Tuttavia, alcuni scienziati sperano che l’approvazione apra la strada a ulteriori terapie geniche. “Avere un grande successo come questo convaliderà un bel po’ la tecnologia”, afferma Jeffrey Chamberlain, un neurologo dell’Università di Washington a Seattle che ha sviluppato alcune delle tecnologie utilizzate da Sarepta.
Perché la DMD è così difficile da trattare?
La DMD sembra un bersaglio diretto per la terapia genica. La malattia colpisce quasi esclusivamente i ragazzi, perché hanno una sola copia del cromosoma X, dove è localizzato il gene della distrofina; le ragazze con una variante che causa la malattia hanno una copia di backup. Sostituire anche alcune proteine funzionanti nelle cellule muscolari dovrebbe invertire la malattia, o almeno arrestarne la progressione.
Ma lo sviluppo di tale sostituzione si è rivelato difficile. La distrofina è il gene più lungo del genoma umano ed è troppo grande per entrare nel vettore del virus adeno-associato (AAV) comunemente usato per somministrare terapie geniche. Sarepta e diverse altre società hanno aggirato questo problema progettando un gene che codifica solo le parti più importanti della proteina (vedi “Grandi geni in piccoli pacchetti”). La risultante “microdistrofina” è solo parzialmente efficace.
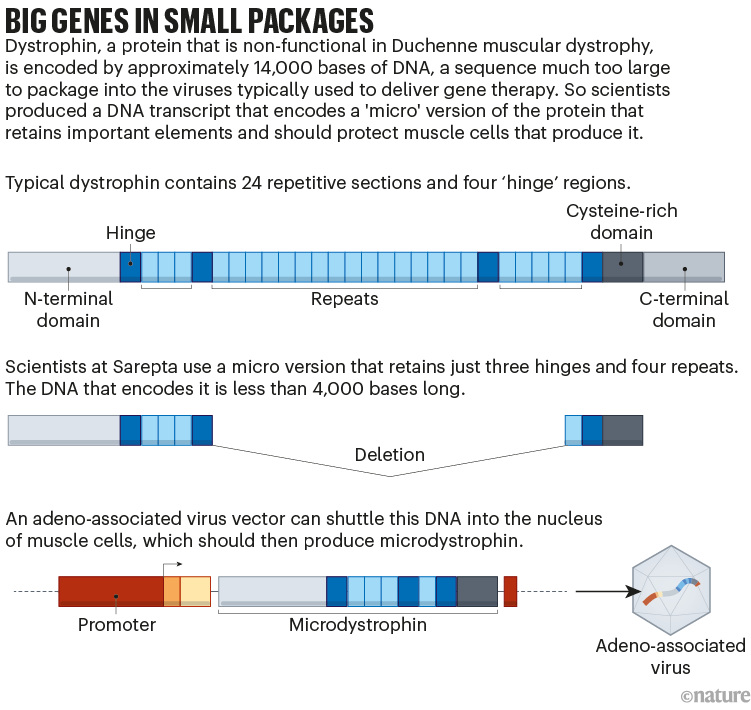
Anche inserire il gene in un numero sufficiente di cellule per fare la differenza è stato impegnativo. I muscoli costituiscono il 30-40% della massa corporea, quindi il trattamento della DMD richiede dosi estremamente elevate del vettore AAV. Ciò aumenta il rischio di effetti collaterali, inclusi danni agli organi. E poiché le cellule muscolari si dividono frequentemente, specialmente in un bambino in crescita, la quantità del gene nel corpo sarà diluita nel tempo. Non è ancora chiaro quanto durerà l’effetto della terapia, anche se i dati di Sarepta su quattro bambini suggeriscono che i miglioramenti clinici possono persistere quattro anni dopo il trattamento.
Quanto è efficace il trattamento?
Sebbene la maggior parte delle approvazioni della FDA richieda che i farmaci superino due studi clinici di fase III controllati con placebo per testare l’efficacia del trattamento, il percorso di approvazione accelerato che Sarepta sta cercando consente alle aziende di fare affidamento su “endpoint surrogati” per dimostrare il loro valore. Queste misure mostrano un effetto biologico – in questo caso, alti livelli di microdistrofina – piuttosto che un miglioramento dei sintomi.
Il primo grande studio di fase III di Sarepta è ancora in corso e i dati dovrebbero essere rilasciati entro la fine dell’anno. La FDA ha invece valutato diversi studi intermedi su un totale di 52 ragazzi dai quattro ai sette anni. Questi hanno mostrato che i muscoli dei ragazzi producevano microdistrofina, ma i bambini non avevano un miglioramento statisticamente significativo della funzione muscolare un anno dopo la somministrazione del farmaco.
I rapporti dell’oOrganizzazione di notizie STAT e altri hanno scoperto che il personale della FDA aveva intenzione di respingere la domanda di Sarepta. Ma Peter Marks, Direttore del Center for Biologics Evaluation and Research (CBER) della FDA, è intervenuto, programmando un incontro pubblico con un comitato consultivo scientifico indipendente il 12 maggio, per valutare se il farmaco debba ricevere un’approvazione accelerata. Questo comitato ha raccomandato in modo restrittivo l’approvazione con otto voti contro sei. Sebbene la FDA non debba seguire il consiglio del comitato, in genere lo fa.
Il comitato consultivo ha valutato le prove per marcatori surrogati anche per i benefici clinici. Alcuni di coloro che hanno votato a favore della terapia affermano che poiché la DMD progredisce lentamente, potrebbe essere difficile determinare l’effetto del farmaco dopo un solo anno. Ma quando Sarepta ha esaminato solo i 32 ragazzi di età inferiore ai sei anni che hanno ricevuto SRP-9001 o un placebo, la funzione muscolare dei ragazzi trattati è migliorata significativamente.
Il miglioramento statisticamente significativo nei ragazzi più giovani è stato sufficiente a convincere Donald Kohn, un membro del comitato consultivo della FDA che si occupa di ricerca sulle cellule staminali presso l’Università della California di Los Angeles, a votare a favore del farmaco.
Quali sono i rischi della terapia genica per la DMD?
Oltre ai rischi derivanti dalle grandi quantità di AAV necessarie per portare il gene della microdistrofina nei muscoli, il gene stesso sembra causare gravi effetti collaterali in alcuni bambini. La FDA aveva sospeso diversi studi sulla terapia genica della DMD a causa di problemi di contaminazione e pazienti che si ammalavano gravemente. E nel 2021, l’agenzia ha temporaneamente interrotto uno studio della Pfizer, con sede a New York City, che sta testando la propria versione della microdistrofina, dopo la morte di un paziente.
Per indagare sul problema, Pfizer, Sarepta e Solid Biosciences, con sede a Charlestown, Massachusetts, hanno deciso di mettere insieme i loro dati sulla microdistrofina. Il loro studio, che sarà presto pubblicato sul New England Journal of Medicine, ha scoperto che alcune mutazioni nel gene della distrofina fanno sì che il sistema immunitario riconosca la microdistrofina come un invasore estraneo e la attacchi, causando una pericolosa infiammazione nei muscoli e nel cuore. Le aziende hanno iniziato lo screening genetico dei partecipanti alla sperimentazione clinica ed escludendo quelli con le mutazioni rilevanti – meno del 5% nel caso di Sarepta – che per ora elimina il problema. Ma Carsten Bönnemann, neurologo presso il National Institute of Neurological Disorders and Stroke di Bethesda, nel Maryland, che ha co-condotto lo studio, afferma che le terapie geniche alla fine dovranno essere adattate per aiutare questi pazienti.
Tuttavia, Hesterlee osserva che anche coloro che sono idonei per la nuova terapia approvata da Sarepta hanno davanti a sé una scelta difficile. Le terapie geniche AAV possono essere somministrate una sola volta nella vita di una persona: una volta che il sistema immunitario ha incontrato un vettore virale, è probabile che lo attacchi in futuro. E poiché l’AAV è il vettore di scelta per la maggior parte delle terapie geniche, i genitori di un bambino con DMD potrebbero dover scegliere se trattare il loro bambino ora, con l’unica terapia approvata o aspettare nella speranza che Sarepta o un’altra azienda rilasci qualcosa di meglio in futuro. Ciò significa consentire alla malattia di progredire e potenzialmente stabilizzarla solo dopo che i ragazzi hanno perso più funzionalità muscolare. “Pochi mesi possono essere molto per le famiglie”, dice Hesterlee.
Vedi anche:Distrofia di Duchenne: nuovo audace metodo di somministrazione della terapia
E altri ricercatori stanno esaminando vettori alternativi, tra cui capsule lipidiche, nanoparticelle, anticorpi che portano i geni della distrofina alle cellule muscolari e virus che si integrano nel genoma di un paziente. Questi trattamenti, almeno in teoria, potrebbero essere somministrati a persone che hanno già ricevuto la terapia genica AAV.
In che modo questa approvazione influenzerà altre terapie geniche?
Lo sviluppo della terapia genica è sempre stato un affare rischioso e costoso e la recente recessione economica ha visto chiudere molte biotecnologie. Tuttavia, il numero di approvazioni di terapie geniche da parte della FDA è aumentato ogni anno dalla sua prima – Kymriah per la leucemia – nel 2017.
L’approvazione di una terapia genica per la DMD rappresenterebbe comunque una pietra miliare. Fino ad ora, la maggior parte delle terapie geniche approvate ha affrontato il cancro, malattie estremamente rare e condizioni come i disturbi della retina, che sono facili da prendere di mira con un virus. “La DMD è diversa”, afferma Chamberlain, “sia per il numero di sfide tecniche che i ricercatori hanno dovuto affrontare, sia per il gran numero di pazienti che la terapia potrebbe servire. L’agenzia è ora pronta a prendere in considerazione più di una dozzina di terapie geniche e cellulari quest’anno, comprese due per l’anemia falciforme, una condizione genetica molto più diffusa della DMD.
La FDA sembra dare la priorità a questi approcci. In recenti colloqui, il Direttore del CBER Marks ha affermato che l’agenzia prevede di appoggiarsi maggiormente a percorsi di approvazione accelerati per le terapie geniche, compreso un uso più ampio di endpoint surrogati. “Non possiamo essere così attenti alle nostre approvazioni sotto approvazione accelerata da impedire che le terapie potenzialmente salvavita arrivino sul mercato in modo tempestivo“, ha detto in un discorso di gennaio alla riunione annuale della Muscular Dystrophy Association.
Fonte:Nature