L’osmosi – il movimento naturale dell’acqua in una soluzione attraverso una membrana semipermeabile – è centrale in tutta la biologia
L’osmosi è un fenomeno biofisico in cui l’acqua (o un altro solvente) passa da una soluzione meno concentrata a una soluzione più concentrata attraverso una membrana parzialmente permeabile, che lascia passare alcune particelle bloccandone altre. Questo movimento è talvolta indicato anche come “down the concentration gradient”.
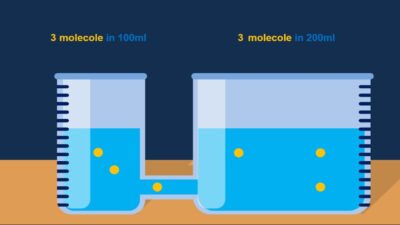
Il solvente manterrà questa migrazione fino al raggiungimento dell’equilibrio nella concentrazione. Immagina due tazze d’acqua, una con un’alta concentrazione di sale e l’altra con una bassa concentrazione. Se dovessi posizionare una membrana semipermeabile tra di loro, l’acqua dalla tazza a bassa concentrazione fluirebbe nella tazza ad alta concentrazione finché la concentrazione su entrambi i lati non sarà uguale.

La pressione osmotica è la forza necessaria per impedire il movimento dell’acqua attraverso la membrana semipermeabile.
Il solvente manterrà questa migrazione fino al raggiungimento dell’equilibrio nella concentrazione.
Immagina due tazze d’acqua, una con un’alta concentrazione di sale e l’altra con una bassa concentrazione. Se dovessi posizionare una membrana semipermeabile tra di loro, l’acqua dalla tazza a bassa concentrazione fluirebbe nella tazza ad alta concentrazione finché la concentrazione su entrambi i lati non sarà uguale.

La pressione osmotica è la forza necessaria per impedire il movimento dell’acqua attraverso la membrana semipermeabile.
Il termine osmosi, che in greco significa ‘spinta’ o ‘impulso’, fu coniato per la prima volta da JA Nollet, che nel 1747 descrisse un esperimento in cui usò una vescica animale per separare due camere contenenti acqua e vino. Notò che il volume nella camera contenente il vino aumentava e, se la camera era chiusa, la pressione aumentava.
Come funziona l’osmosi
Un classico esperimento per l’osmosi consiste nel dividere un bicchiere d’acqua in due metà, con una membrana semipermeabile in mezzo e del sale aggiunto su uno dei lati. Noterai presto che l’acqua migra dal lato del becher senza sale al lato con la soluzione salina. Questo movimento dell’acqua continuerà fino a quando la concentrazione di sale sarà la stessa su entrambi i lati.
La chiave dell’osmosi è la presenza di una membrana semipermeabile che rende più probabile che le molecole d’acqua in una soluzione a bassa concentrazione entrino in collisione con la membrana e la attraversino, mentre le molecole d’acqua in una soluzione concentrata avranno molte meno molecole d’acqua che entrano in collisione con la membrana. Questa discrepanza significa che c’è una maggiore probabilità statistica che più molecole d’acqua passino attraverso la membrana da una soluzione meno concentrata. Una volta che la probabilità statistica del passaggio delle molecole d’acqua attraverso la membrana è uguale, l’osmosi si interrompe.
Osmosi in natura
L’osmosi è uno dei processi essenziali della vita. Ogni cellula del nostro corpo, così come quelle delle piante e degli animali, devono la loro sopravvivenza all’osmosi.
Prendi le piante, per esempio. Quando le innaffiamo, versiamo acqua sull’estremità del gambo e sul terreno. Se le cellule della pianta sono circondate da una soluzione che contiene una maggiore concentrazione di molecole d’acqua (bassa concentrazione di soluto) rispetto alla soluzione all’interno delle cellule, l’acqua entrerà nelle foglie, nei frutti e nei fiori per osmosi. Durante questo processo, la cellula vegetale diventerà solida.
Tuttavia, se una pianta è circondata da una soluzione che contiene una minore concentrazione di acqua (maggiore concentrazione di soluto), le molecole d’acqua della soluzione all’interno delle cellule della pianta verranno espulse per osmosi, rendendo la pianta flaccida.
Le radici di una pianta hanno membrane semipermeabili che consentono all’acqua di fluire all’interno mantenendo fuori le particelle più grandi, come il terreno. L‘acqua quindi risale lungo il fusto e nelle foglie attraverso piccoli vasi chiamati xilema.
Una volta nelle foglie, l’acqua viene utilizzata nel processo di fotosintesi, che converte la luce solare in energia per la pianta. L‘acqua in eccesso viene quindi rilasciata attraverso piccole aperture chiamate stomi. Questo processo è noto come traspirazione e aiuta a regolare la temperatura e l’umidità dell’ambiente circostante.
Forse un altro esempio più riconoscibile di osmosi al lavoro si trova all’interno dei nostri stessi corpi. Quando beviamo acqua, le cellule la assorbono per osmosi proprio come le radici delle piante. La parete cellulare agisce come una membrana semipermeabile, creando una pressione osmotica tra l’interno e l’esterno della cellula. Il sangue è una soluzione più diluita del citoplasma della cellula, quindi l’acqua del sangue attraverserà la parete cellulare. Lo stesso vale per i nutrienti e i minerali, anch’essi trasferiti per osmosi.
Quando la concentrazione di elettroliti, come il sodio o il potassio, su un lato della membrana è più alta dell’altro, l’acqua scorre dentro o fuori la cellula per bilanciare le concentrazioni. Questo processo è essenziale per mantenere la corretta funzione cellulare e la salute generale.
L’uomo ha riconosciuto le potenzialità dell’osmosi fin dall’antichità, impiegandola per conservare i cibi. Gli antichi osservavano che l’aggiunta di sale o zucchero rimuove l’acqua dai tessuti. A quel tempo, il processo era chiamato imbibizione a causa del fatto che i soluti come il sale e lo zucchero attiravano l’acqua dal materiale che toccavano.
Oggi l’osmosi è importante per una serie di settori diversi. Il processo di osmosi inversa è ampiamente utilizzato nel trattamento dell’acqua, in particolare negli impianti di desalinizzazione, dove l’acqua di mare viene forzata attraverso una membrana semipermeabile, che separa il sale e altri minerali disciolti dall’acqua. Questo processo, noto come osmosi inversa, è in grado di rimuovere fino al 99% del sale disciolto, rendendo l’acqua potabile e sicura per l’irrigazione.
Cos’è l’osmosi inversa?
L’osmosi inversa, come suggerisce il nome, è il contrario dell’osmosi. Invece di un solvente, come l’acqua, che scorre da una soluzione meno concentrata a una più concentrata, scorre nella direzione opposta, attraverso una membrana semipermeabile, da una soluzione più concentrata a una meno concentrata. Ciò accade quando viene applicata pressione su un lato della membrana.
L’osmosi inversa viene tipicamente utilizzata nei sistemi di purificazione dell’acqua, dove l’obiettivo è rimuovere impurità come batteri, virus e solidi disciolti come sale, fluoruro e metalli pesanti. Il processo inizia pressurizzando l’acqua, forzandola attraverso una membrana semipermeabile. Mentre l’acqua scorre attraverso la membrana, le impurità vengono lasciate indietro, creando un flusso d’acqua purificato dall’altra parte.
I sistemi di osmosi inversa possono variare nel design e nella complessità, ma in genere sono costituiti da diversi componenti chiave. Questi includono un prefiltro, che rimuove le particelle più grandi come sedimenti e sporco, una pompa ad alta pressione, che aumenta la pressione dell’acqua per forzarla attraverso la membrana, e la stessa membrana semipermeabile, che è responsabile della rimozione delle impurità.