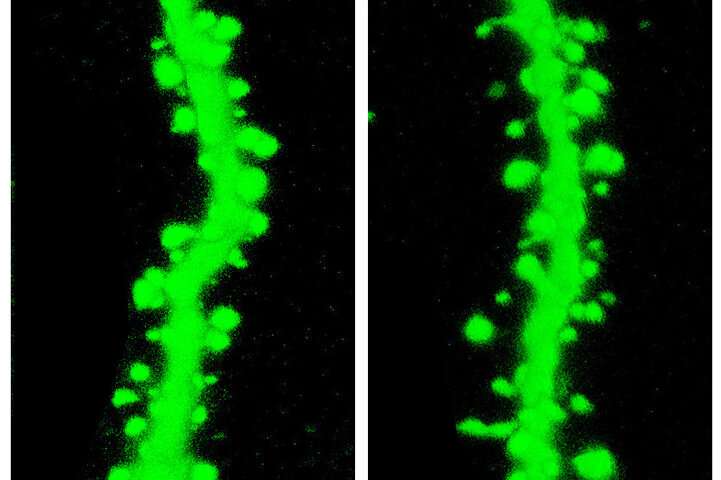
Immagine, topi mutanti con compromissione della funzione del gene SETD1A hanno mostrato anomalie nel meccanismo neuronale con cui comunicano le cellule cerebrali. Ad esempio, c’erano spine meno del normale (a destra), necessarie per trasmettere segnali, su rami di neuroni – rispetto a quelle dei topi normali (a sinistra). Credito: Jun Mukai / Gogos Lab / Columbia’s Zuckerman Institute.
I ricercatori hanno scoperto nei topi come uno dei pochi geni definitivamente collegati alla schizofrenia, chiamato SETD1A, probabilmente rappresenti un rischio per la malattia. I topi geneticamente progettati per mancare di una versione funzionante del gene codificante per l’ enzima hanno mostrato anomalie nella memoria di lavoro, imitando quelle comunemente osservate nei pazienti con schizofrenia.
Il ripristino della funzione del gene ha corretto il deficit della memoria di lavoro.
La lotta alle carenze del gene ha anche riparato i deficit dei circuiti neuronali nei topi adulti, suggerendo indizi per potenziali strategie di trattamento. Un team di scienziati guidato da Joseph Gogos, M.D., Ph.D., della Columbia University, New York City, ha riferito delle loro ricerche, supportate dal National Institutes of Health, a Neuron.
“Potresti definire SETD1A un regolatore principale “, ha spiegato David Panchision Ph.D., del National Institute of Mental Health (NIMH) del NIH, che ha cofinanziato lo studio.” Questo gene rischia di codificare un enzima che influenza l’espressione di molti altri geni. Nei topi, una versione anomala di SETD1A ha interrotto l’espressione genica in una rete che ospita altri sospetti genomici nella schizofrenia. Sorprendentemente, le anomalie risultanti erano reversibili”.
Vedi anche, Nuova speranza di trattamento per la schizofrenia.
I ricercatori hanno identificato variazioni genetiche sia rare che comuni che contribuiscono al rischio di schizofrenia. Il mutante SETD1A è uno dei pochi geni rari noti per conferire inequivocabilmente il rischio di schizofrenia. Mentre le variazioni genetiche comuni legate alla schizofrenia esercitano individualmente solo piccoli effetti sul rischio, avere una sola copia mutata di SETD1A è sufficiente per conferire un grande aumento del rischio di malattia. SETD1A svolge un ruolo chiave nella regolazione epigenomica — l’accensione e lo spegnimento dei geni in risposta all’esperienza — un processo molecolare diffuso nel cervello. Le mutazioni di SETD1A sono state riscontrate principalmente nelle persone con schizofrenia, suggerendo che questa rara variazione genetica potrebbe contenere importanti indizi sul processo patologico di base.
Per scoprire come una tale mutazione in SETD1A influenzi le cellule cerebrali, i circuiti e il comportamento, Gogos e colleghi hanno modellato gli effetti nei topi portatori di una mutazione che dimezza l’espressione del gene.
I topi geneticamente modificati vacillavano in compiti che richiedevano la navigazione di un labirinto per ricevere una ricompensa. I compiti testano la memoria di lavoro degli animali – tenendo a mente le informazioni e recuperandole per guidare il comportamento – un’abilità spesso compromessa nella schizofrenia.
Il gene mutato ha anche interrotto il meccanismo cellulare attraverso il quale i neuroni comunicano tra loro. Ad esempio, ha rallentato la crescita e la ramificazione delle estensioni cellulari e ha ridotto il numero di spine su queste estensioni, necessarie per trasmettere segnali chimici dalle cellule vicine agli impulsi elettrici.
Alla base di tale alterata crescita e funzione neuronale, i ricercatori hanno scoperto che il gene mutato SETD1A ha interrotto la regolazione di molti altri geni con cui è collegato. Intere classi di geni erano sottorappresentate mentre altre erano sovraespresse, a seconda della loro relazione con il gene. Una classe si è sovrapposta in modo evidente alla variazione genetica associata alla schizofrenia nei neuroni chiave (piramidali) del mantello esterno del cervello, o corteccia, con probabili effetti cumulativi sulla struttura e sulla funzione cellulare.
Il ripristino sperimentale della normale espressione di SETD1A nei topi adulti ha ripristinato la funzione della memoria di lavoro degli animali. Inoltre, l’inibizione dell’espressione di un gene chiamato LSD1, che contrasta SETD1A, ha corretto tutte le anomalie comportamentali e di comunicazione neuronale degli animali. Le prove hanno indicato che molti di questi meccanismi identificati nel cervello del topo sono stati conservati attraverso l’evoluzione e probabilmente svolgono ruoli simili negli esseri umani.
“Riattivare la funzione di SETD1A o contrastare gli effetti a valle della carenza di SETD1A nel cervello adulto, forse con inibitori LSD1, può essere promettente per il trattamento dei deficit cognitivi della schizofrenia”, suggeriscono i ricercatori.
“Sebbene le mutazioni SETD1A esistano in una piccola percentuale di tutti i pazienti affetti da schizofrenia, molte persone con diagnosi del disturbo hanno problemi simili a quelli causati da questa mutazione”, ha spiegato Gogos. “Pertanto, le terapie specifiche di SETD1A possono effettivamente avere implicazioni più ampie per la schizofrenia nel suo insieme”.
Fonte, Neuron