Un nuovo studio pubblicato sulla rivista Neuron il 9 ottobre 2019 riporta che gli scienziati hanno svelato parte dei segreti del gene SETD1A e come le mutazioni nel gene mettono a rischio l’individuo di sviluppare la schizofrenia.
I ricercatori hanno inattivato questo gene, che chiamano “un regolatore principale”, in un modello murino, producendo perdita di memoria di lavoro, proprio come nei pazienti con schizofrenia. D’altra parte, ripristinare la funzione del gene ha riportato la memoria di lavoro alla normale funzione. Inoltre, l’inversione di questa inattivazione nei topi adulti ha portato anche al miglioramento dei circuiti neuronali interessati. Ciò dimostra che è possibile trattare i pazienti con schizofrenia a causa di anomalie SETD1A.
Il ricercatore David Panchision afferma: “Questa schizofrenia rischia di codificare i geni per un enzima che influenza l’espressione di molti altri geni. Nei topi, una versione di SETD1A ha interrotto l’espressione genica in una rete che ospita altri sospetti genomici nella schizofrenia. Sorprendentemente, le anomalie risultanti erano reversibili”.
Il gene SETD1A
Il gene SETD1A è tra i pochi che possono essere sicuramente associati alla schizofrenia. Questo gene esiste in diverse forme, alcune delle quali sono rare, mentre altre sono comuni. Tuttavia, tutte queste forme del gene aumentano il rischio di schizofrenia, rendendo le mutazioni SETD1A uno dei pochi fattori genetici che sicuramente sono noti per mettere a rischio l’individuo per questa psicosi. Ci sono una serie di altri cambiamenti genetici che sono più comuni nella schizofrenia, ma contribuiscono al rischio con piccoli effetti individuali. Tuttavia, avere un solo gene SETD1A anomalo aumenta notevolmente il rischio di schizofrenia.
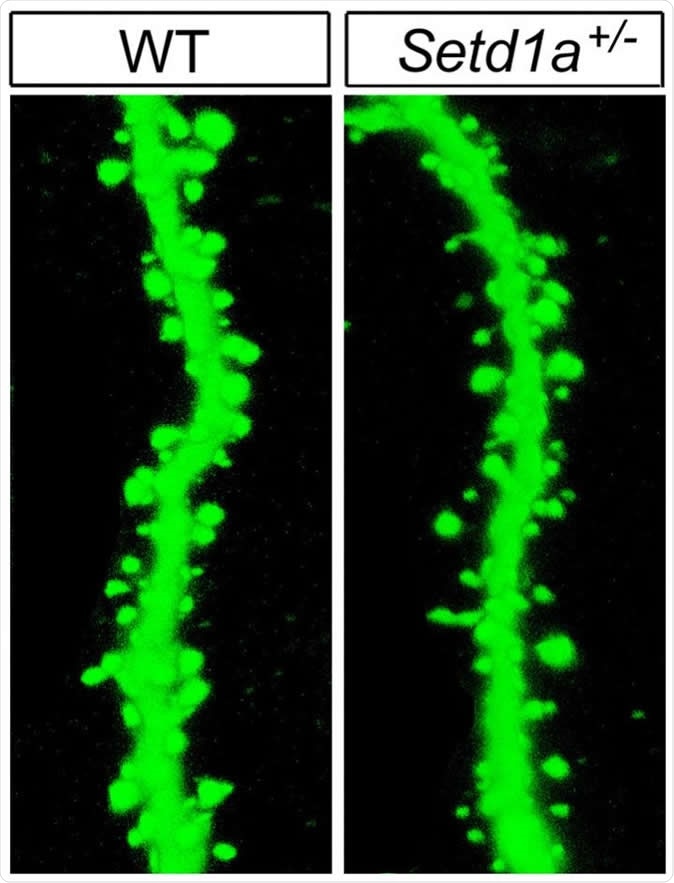
Topi mutanti con compromissione della funzione del gene SETD1A hanno mostrato anomalie nel meccanismo neuronale con cui comunicano le cellule cerebrali.
SETD1A e apprendimento basato sull’esperienza
In che modo SETD1A è coinvolto nell’elaborazione cognitiva del cervello?
Gli scienziati hanno scoperto che questo gene è vitale nella regolazione dei geni coinvolti nel funzionamento del cervello tramite marcatori epigenetici. Ciò significa che l’esperienza “insegna” al cervello a cambiare il modello di espressione di alcuni geni – equivale a accenderli e spegnerli – mediante l’attacco mediato da enzimi di specifici gruppi chimici in determinati punti alla struttura del DNA. Questo è un processo che si verifica in tutto il cervello.
Le mutazioni nel gene SETD1A sono rare, ma la maggior parte si verifica in pazienti con schizofrenia. Ciò potrebbe aiutare a svelare il meccanismo sottostante che causa la schizofrenia.
Lo studio e i suoi risultati
L’attuale esperimento è stato impostato in un modello murino, per esplorare gli effetti di una mutazione SETD1A sui neuroni cerebrali, sui percorsi neurali e sul comportamento dell’ospite. I topi utilizzati nello studio presentavano una mutazione che causava solo il 50% della normale attività genica.
A questi topi è stato assegnato il compito di attraversare un labirinto con una ricompensa alla fine. Non sono riusciti a imparare il compito diversamente dai topi normali, dimostrando che la loro mutazione aveva influenzato la loro memoria di lavoro. La memoria di lavoro è la funzione cognitiva che ci aiuta a conservare le informazioni nella memoria, in modo che possa essere utilizzata per guidare il comportamento quando richiesto. Quando la memoria di lavoro fallisce, l’apprendimento diventa compromesso e quindi i compiti diventano molto difficili – una caratteristica che è comunemente osservata nei pazienti con schizofrenia.
Vedi anche, Come un gene collegato alla schizofrenia causa deficit cognitivi.
Effetti neuronali
A livello cellulare, la mutazione riduce la crescita dendritica e la ramificazione assonale. I dendriti sono le proiezioni ramificate su neuroni che ricevono impulsi nervosi in arrivo. I topi con la mutazione SETD1A avevano anche un minor numero di spine dendritiche (estensioni simili a capelli dei dendriti). Questi cambiamenti ritardano la trasmissione degli impulsi nervosi tra le cellule adiacenti perché compromettono la conversione chimico-elettrica nel cuore della produzione del segnale nervoso.
Effetti della trascrizione genica
Ancora più importante è stata la scoperta che la mutazione SETD1A ha indotto l’interruzione di molti altri geni collegati che iniziano o aumentano il processo di espressione genica (“promotori; e” esaltatori “, rispettivamente). Questo potrebbe aiutare a spiegare i cambiamenti nella struttura e nella funzione neuronale. I ricercatori hanno scoperto che non solo singoli geni ma intere classi di geni erano espressi a un livello inferiore mentre altri erano sovraregolati, in base al livello di rete con il gene. La proteina espressa dal gene SETD1A è un gene lisina-metiltransferasi e si lega alle sequenze di potenziatore e promotore per modulare la sintesi di RNA neuronale. Molti esaltatori che legano SETD1A legano anche il prodotto del gene MEF2.
Una di queste classi genetiche ha mostrato una marcata sovrapposizione con varianti genetiche presenti in importanti neuroni piramidali della corteccia cerebrale, in pazienti con schizofrenia. SETD1A si lega ai siti dei promotori per iniziare la trascrizione, mentre si lega ai potenziatori che si sono associati a MEF2 per produrre l’effetto opposto. Pertanto, l’associazione dei cambiamenti in due diversi gruppi di geni potrebbe quindi causare un accumulo di effetti genetici sulla struttura e sulla funzione dei neuroni, secondo i ricercatori.
Inversione degli effetti
Infine, gli scienziati hanno riportato l’espressione del gene SETD1A nei topi adulti al suo livello normale, e questo a sua volta ha riportato la normale memoria di lavoro. L’esperimento prevedeva anche l’uso di un inibitore che antagonizzava l’azione del gene LSD1 (che contrasta gli effetti di SETD1A rimuovendo il gruppo metilico). Ciò ha ripristinato le azioni SETD1A e ha portato a una correzione completa di tutte le anomalie comportamentali e dei deficit nei circuiti neurali e nella comunicazione.
I ricercatori sono entusiasti della possibilità che la riattivazione di SETD1A o il contrasto dei cambiamenti cerebrali conseguenti alla carenza di SETD1A (come l’uso di inibitori dell’LSD1, come in questo esperimento) possano un giorno aiutare a ripristinare il deterioramento cognitivo nella schizofrenia. Il ricercatore Joseph Gogos spiega: “Sebbene le mutazioni SETD1A esistano in una piccola percentuale di tutti i pazienti affetti da schizofrenia, molte persone con diagnosi di schizofrenia hanno problemi simili a quelli causati da questa mutazione. Pertanto, le terapie specifiche di SETD1A possono effettivamente avere implicazioni più ampie per la schizofrenia nel suo complesso”.
Immagine, topi mutanti con compromissione della funzione del gene SETD1A hanno mostrato anomalie nel meccanismo neuronale con cui comunicano le cellule cerebrali. Ad esempio, c’erano spine meno del normale (a destra), necessarie per trasmettere segnali, su rami di neuroni – rispetto a quelle dei topi normali (a sinistra). Credito di immagine: Jun Mukai / Gogos Lab / Columbia’s Zuckerman Institute.
Fonte, Neuron