Non puoi capire il ciclo di vita di una cellula senza sapere come muore.
Nuove scoperte sono emerse da una nuova serie di indagini che sfidano la saggezza scientifica prevalente sul modo in cui le cellule muoiono sotto l’influenza della chemioterapia. La ricerca getta nuova luce sulla piroptosi nel trattamento del cancro basato sulla chemio, ampliando il possibile numero di percorsi proteici coinvolti in questa forma di morte cellulare e suggerendo che in futuro potrebbero essere trovati ancora altri percorsi.
Il Dottor Bowen Zhou, patologo della School of Medicine della Case Western Reserve University, in Ohio, che ha guidato la nuova ricerca, fornisce una lezione pratica sulla piroptosi, spiegando che “in risposta alla chemioterapia, l’induzione della morte cellulare per apoptosi può essere convertita in una forma di morte delle cellule chiamata piroptosi“.
Il termine “morte cellulare litica” o “lisi cellulare” si riferisce alla rottura di una cellula causata da un danno irrevocabile alla sua membrana più esterna. Una cellula non può sopravvivere quando il suo contenuto fuoriesce dai buchi, e questo è ciò che riguarda la piroptosi. Durante la piroptosi, una cascata di reazioni molecolari perfora i grandi pori delle membrane cellulari, destabilizzando irrevocabilmente e, infine, distruggendo le cellule.
Il team di Case Western sostiene inoltre che affinché la chemio abbia un impatto, deve innescare percorsi biologici che portano alla morte cellulare. L’elegante ricerca degli scienziati, che include analisi del sangue e biopsie del midollo osseo di pazienti con leucemia mieloide acuta, apre una nuova finestra di comprensione sui molteplici percorsi che la piroptosi può essere innescata sotto l’influenza della chemio.
“La piroptosi è un meccanismo di morte cellulare programmata e necrotica mediata dalle gasdermine, una famiglia di proteine che formano i pori”, riferisce Zhou, autore principale dell’articolo sulla piroptosi nei tumori del sangue. La ricerca, pubblicata sulla rivista Science Signaling, evidenzia diversi percorsi di formazione dei pori che possono portare alla morte cellulare sotto l’influenza di agenti chemioterapici ampiamente utilizzati.
Oltre al loro ruolo nella morte delle cellule tumorali tramite piroptosi, le gasdermine che formano pori nelle membrane cellulari, sono una famiglia di proteine implicate anche nella risposta immunitaria. Una di queste proteine, gasdermin D, ha dominato la morte delle cellule tumorali quando indotta dalla formazione di inflammasomi che attivano la caspasi-1. Ma la storia della piroptosi apparentemente non inizia e finisce con il gasdermin D o il suo cugino stretto, gasdermin E. “E’ una saga molecolare molto più complessa di quanto riportato da altri studi”, affermano gli scienziati.
“Caspase-1 attiva gasdermin D in condizioni infiammatorie, mentre caspase-3 attiva gasdermin E in condizioni apoptotiche, come quelle indotte dalla chemioterapia”, ha affermato Zhou. “Si pensa che questi percorsi siano separati.
“Tuttavia, abbiamo scoperto che fanno parte di una rete integrata di guardiani che consente la morte delle cellule pirototiche. Abbiamo osservato che gasdermin D era il principale mediatore pirototico nelle cellule del sangue in coltura in risposta alla Doxorubicina e all’Etoposide, due comuni chemioterapie per le neoplasie ematopoietiche“.
Per inciso, solo per illustrare quanto siano complesse le gasdermin in salute e malattia, un’altra proteina gasdermin, gasdermin A, insieme alò+la gasdermin D, è stata inoltre implicata nelle malattie autoimmuni e in alcuni tipi di cancro. Tuttavia, come riportato in dettaglio nello studio Case Western University, le proteine gasdermin sono degne di nota per le loro capacità di formazione dei pori, in particolare sotto l’influenza della chemioterapia.
La ricerca di Zhou e colleghi offre nuove informazioni sui percorsi pirototici scoprendo molteplici percorsi verso la morte delle cellule tumorali, una posizione contraria alla saggezza scientifica prevalente. Anche se un’elevata abbondanza di gasdermin E ha avuto un effetto dominante, la conversione in piroptosi nelle cellule mieloidi umane potrebbe essere mediata in modo indipendente tramite la proteina transmembrana pannexin-1, un canale noto anche come PANX1. Ciò si è verificato attraverso l’induzione di un percorso piroptotico alternativo dipendente da gasdermin D o completamente indipendente dalle gasdermin.
Nelle analisi del sangue e biopsie del midollo osseo di 15 pazienti affetti da leucemia, l’abbondanza relativa di gasdermin E, gasdermin D e PANX1 ha predetto quale percorso avrebbe mediato la morte delle cellule pirototiche in risposta all’esposizione alla chemioterapia.
Vedi anche:Chemioterapia: arriva un nuovo tipo
Astratto grafico:
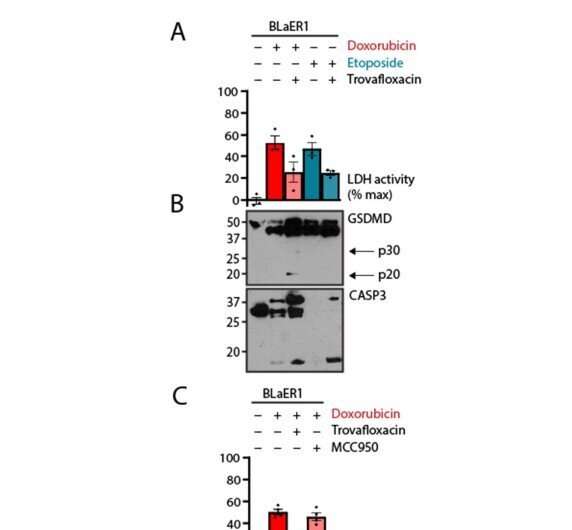
Immagine: le cellule linfoidi BLaER1 subiscono una lisi dominante PANX1. (da A a C) Le cellule BLaER1 sono state trattate con veleni di topoisomerasi doxorubicina (2 μM) o etoposide (50 μM) per 24 ore. Il trattamento concomitante con l’inibitore PANX1 trovafloxacina (20 μM) o l’inibitore dell’inflammasoma NLRP3 MCC950 (10 μM) era come indicato. In (A e C), quantificazione della rottura della membrana plasmatica mediante analisi della lattato deidrogenasi del supernatante privo di cellule; e in (B), immunoblot di cellule trattate come indicato. I punti del grafico rappresentano ≥ 2 repliche tecniche per replica biologica; le barre del grafico rappresentano la media ± errore standard di ≥ 3 repliche biologiche per esperimento; e gli immunoblot sono rappresentativi di ≥ 3 repliche biologiche. Credito:Science Signaling-
Il messaggio da portare a casa da questo studio multifocale è: le cellule tumorali non muoiono semplicemente perché sono state esposte alla chemio. Muoiono attraverso un meccanismo programmato che può procedere attraverso uno qualsiasi dei numerosi percorsi di segnalazione. Zhou e colleghi hanno anche ampiamente dimostrato che la pirotosi durante la chemioterapia non si basa esclusivamente su gasdermin E. Studiando le cellule mieloidi umane esposte alla chemio, gli scienziati hanno scoperto che la pirotosi può anche procedere attraverso PANX1. E anche di fronte alla ricerca che sfida i dogmi, potrebbero esserci altri percorsi di formazione dei pori che devono ancora essere trovati.
“Andando avanti, sarà fondamentale analizzare attentamente il ruolo delle proteine che formano i pori, comprese quelle non ancora implicate, nelle neoplasie ematologiche e forse in altre neoplasie per adattare una risposta terapeutica appropriata”, ha concluso Zhou.
Fonte:Science Signaling