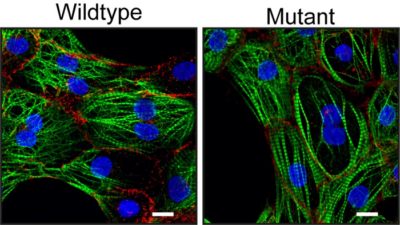
Cardiomiopatia aritmogena-Immagine: cellule del muscolo cardiaco senza (wildtype) o con (mutante) la nuova mutazione scoperta. Sono visibili le proteine presenti nelle cellule del muscolo cardiaco in particolare (verde), le proteine desmosomiali (rosse) e i nuclei cellulari (blu). Credit: Jantine Monshouwer-Kloots, copyright Hubrecht Institute-
I ricercatori del gruppo di Eva van Rooij in collaborazione con l’UMC Utrecht hanno identificato una nuova mutazione che porta alla cardiomiopatia aritmogena (ACM). Hanno valutato l’effetto di questa mutazione sulle cellule del muscolo cardiaco e hanno ottenuto nuove informazioni sul meccanismo sottostante che causa la malattia. I risultati di questo studio, pubblicati il 2 marzo su Stem Cell Reports, potrebbero contribuire allo sviluppo di nuovi trattamenti per l’ACM.
Desmosomi
Milioni di cellule del muscolo cardiaco si contraggono per consentire al cuore di svolgere la sua funzione di pompaggio. Per assicurarsi che queste contrazioni vengano eseguite correttamente, è importante che le singole cellule del muscolo cardiaco comunichino tra loro. Pertanto, le cellule del muscolo cardiaco devono essere strettamente collegate tra loro. In un cuore sano, queste connessioni sono costituite da complesse strutture proteiche che formano un ponte tra le cellule, i cosiddetti desmosomi. Quando si verificano mutazioni nei geni che contribuiscono a queste strutture, ciò può portare allo sviluppo della cardiomiopatia aritmogena (ACM). L’ACM è una malattia progressiva e spesso ereditaria in cui il cuore non riesce a contrarsi correttamente. Anche se 1 persona su 5000 sviluppa ACM per tutta la vita, molto rimane sconosciuto sulla malattia e non esistono opzioni terapeutiche efficaci per curare i pazienti.
Scoperta di una nuova mutazione
“Abbiamo studiato il materiale genetico di un paziente ACM e abbiamo riscontrato una mutazione precedentemente sconosciuta nel gene desmoplakin“, afferma il primo autore dello studio Sebastiaan van Kampen. Desmoplakinè uno dei geni responsabili della formazione dei desmosomi. Per studiare il ruolo di questa mutazione nell’insorgenza di ACM, i ricercatori hanno coltivato cellule del muscolo cardiaco dal paziente in laboratorio. Van Kampen dice: “Abbiamo confrontato queste cellule del muscolo cardiaco con le stesse cellule del muscolo cardiaco in cui abbiamo riparato la mutazione usando CRISPR/Cas9. Le cellule del muscolo cardiaco che contenevano la mutazione si sono rivelate meno strettamente connesse”. Inoltre, i ricercatori hanno scoperto che queste cellule hanno meno canali ionici. Questi canali sono cruciali per un’efficiente propagazione del potenziale d’azione, un segnale elettrico che stimola la contrazione, tra le cellule del muscolo cardiaco. Da ciò, i ricercatori hanno concluso che la nuova mutazione può portare alla cardiomiopatia aritmogena.
Vedi anche:Cardiomiopatia dilatativa: scoperta la mutazione genetica responsabile
Meccanismo sottostante
È noto che più mutazioni portano alla cardiomiopatia aritmogena. Tuttavia, il meccanismo sottostante che porta alla malattia rimane in gran parte sconosciuto. I ricercatori hanno utilizzato le cellule del muscolo cardiaco in coltura del paziente come modello per la malattia. Hanno scoperto che una proteina chiamata PITX2 è maggiormente espressa nelle cellule del muscolo cardiaco “malate” e che questa proteina è in parte responsabile della perdita di desmosomi e canali ionici. “Quando abbiamo rimosso la proteina dalle cellule del muscolo cardiaco malato, i livelli dei canali ionici e delle proteine desmosomiali nelle cellule del paziente hanno mostrato un notevole recupero», spiega Van Kampen. La proteina PITX2 svolge quindi un ruolo importante nei cambiamenti nelle cellule del muscolo cardiaco mutate.
Cure future
Lo studio, pubblicato su Stem Cell Reports, può potenzialmente contribuire allo sviluppo di nuovi trattamenti per l’ACM. Inoltre, i risultati di questo studio offrono nuove informazioni sullo sviluppo dell’ACM che possono essere preziose per la ricerca futura. “Sebbene non sappiamo in che modo la nuova mutazione porta a un aumento dei livelli di PITX2, vediamo lo stesso accadere in una seconda mutazione. È possibile che l’aumento dei livelli di PITX2 porti all’ACM nel contesto di molte più mutazioni”, afferma Eva van Rooij, capogruppo dell’Istituto Hubrecht e ultima autrice dello studio. Sono quindi essenziali ulteriori ricerche su queste diverse mutazioni. Eva van Rooij è leader del gruppo presso l’Istituto Hubrecht e Professore di cardiologia molecolare presso l’UMC Utrecht.
Fonte:Stem Cell Reports