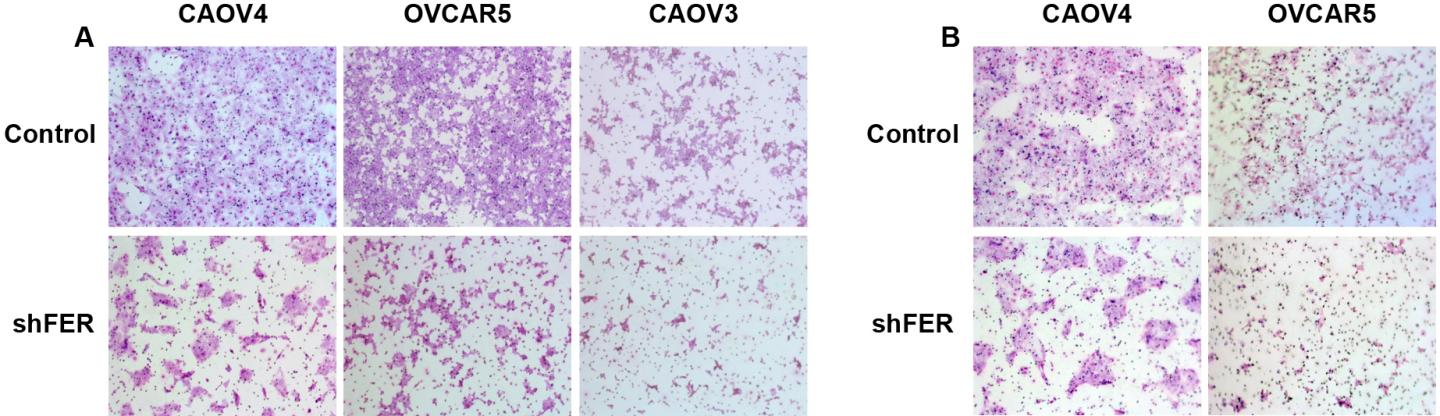
Immagine: Il pannello di sinistra (A) mostra la motilità; il pannello di destra (B) invasività. FER è attivo nelle cellule di controllo, fila superiore, (A) e (B); FER è inattivo nelle corrispondenti celule nella riga inferiore, (A) e (B).
Come il cancro al pancreas, anche il cancro ovarico è noto per essere scoperto in una fase relativamente tardi, dopo che si è esteso in altre parti del corpo. Non a caso è chiamato “il killer silenzioso”. Circa due terzi delle donne che vengono diagnosticate, scoprono la malattia al terzo stadio o più tardi, una volta che le metastasi hanno iniziato a diffondersi. Meno del 25% di queste donne sopravvive a 5 anni, mentre il dato corrispondente per chi ha la fortuna di essere diagnosticata nella prima o seconda fase, quando il tumore è ancora localizzato, è tra il 70% e il 90%.
Oggi, un team di ricercatori del Cold Spring Harbor Laboratory riporta sulla rivista Genes & Development, due “nuove intuizioni sugli eventi di segnalazione che sono alla base dello sviluppo delle metastasi nelle cellule del cancro ovarico”, spiega Gaofeng Fan, Ph.D., ricercatore che condotto la maggior parte degli esperimenti nel laboratorio del Prof. Nicholas K. Tonks del CSHL
“Le statistiche indicano l’urgente necessità di affrontare la malattia avanzata – le metastasi – nel carcinoma ovarico”, dice Fan. “Il problema è particolarmente difficile da risolvere a causa di una caratteristica specifica di questa forma di cancro: le cellule ovariche possono muoversi facilmente all’interno della cavità peritoneale, attraverso il fluido peritoneale, sia in condizioni normali che, purtroppo, quando il cancro è presente. Pertanto, oltre ad essere in grado di colonizzare altre parti del corpo attraverso i vasi sanguigni, le cellule del cancro ovarico hanno un’ altra strategia di migrazione. E’ molto difficile combattere la malattia attraverso un intervento chirurgico a causa di questa caratteristica diffusione del cancro “.
( Vedi anche: Nuova strategia per combattere il cancro ovarico).
Fan, Tonks e colleghi, hanno trovato una via ad oggi sconosciuta, attraverso la quale le cellule ovariche possono essere trasformate in cellule tumorali che offre un’eccellente opportunità per il target per nuovi farmaci che, se combinati con altri ora in fase di sviluppo, possono evitare la diffusione metastatica.
Il percorso appena scoperto dipende dall’ attività di una proteina chiamata FER, un membro di una famiglia di proteine (chiamate non-recettore tirosin chinasi) che aggiungono gruppi fosfato ad altre proteine. FER può essere trovata galleggiante nel citoplasma delle cellule e in una serie di esperimenti iniziali, il team ha dimostrato che è “upregulated”, cioè prodotta in eccesso nelle cellule del cancro ovarico, e, soprattutto, è responsabile della motilità elevata e dell’ invasività di tali cellule. Tutto questo è stato osservato sia nelle cellule di cancro ovarico umano in coltura che in modelli murini della malattia.
La scoperta chiave fatta dal team CSHL è che FER è in grado di attivare un recettore sulla superficie delle cellule ovariche “dal basso”, per così dire – interagendo con una porzione del recettore che penetra la membrana cellulare e si immerge nel citoplasma . Questo recettore è un obiettivo ben noto nel carcinoma ovarico. E’ chiamato MET e in genere si attiva quando un fattore di crescita chiamato HGF lo lega alla superficie delle cellule. MET è sovraespresso nel 60% dei tumori ovarici e la sua attivazione è stata implicata sia nello sviluppo del cancro nelle fasi iniziali che nei tumori avanzati con prognosi infausta.
Non sorprende, allora, che MET sia il bersaglio di una serie di sforzi per lo sviluppo di farmaci che hanno in comune l’obiettivo di bloccare l’attivazione di MET. Finora, candidati inibitori-MET hanno avuto effetti antitumorali deboli quando somministrati da soli. “Sembra che le cellule tumorali ovariche abbiano trovato altre modalità di attivazione pro-cancro ‘a valle’ di MET”, dice Fan.
L’importanza della ricerca è determinata dalla scoperta di come MET si attiva “dal basso”, cioè in assenza di un fattore di crescita di aggancio alla superficie del recettore. Questa forma di attivazione è chiamata “non-ligando-dipendente”. In una complessa serie di esperimenti biochimici i ricercatori hanno tracciato il percorso attraverso il quale FER si lega a MET e all’interno della cellula innesca una cascata di eventi di segnalazione cellulare tra cui RAC1 / PAK1 e SHP2-ERK, tutti collegati direttamente, anche nella ricerca precedente, con l’inizio dello sviluppo del cancro.
Tramite compensazione con queste cascate di oncogeni, FER, semplicemente aggiunge un fosfato al recettore MET, diventando essa stessa un bersaglio farmacologico potenzialmente attraente. Questa ipotesi è particolarmente vera in quanto in modelli animali di cancro ovarico, il team ha dimostrato che la soppressione di FER riduce la motilità delle cellule tumorali e drasticamente riduce anche lo sviluppo delle metastasi.
“Abbiamo dimostrato che FER è essenziale per la motilità delle cellule tumorali dell’ovaio e per la loro invasività, sia in vitro che in vivo”, dice Tonks. “Considerando che spesso l’amplificazione di MET rappresenta la resistenza alle terapie attualmente in fase di sviluppo e la causa di prognosi sfavorevole, non solo nel carcinoma ovarico ma anche in altri tipi di cancro, i nostri risultati hanno individuato un nuovo importante polo di segnalazione che coinvolge il ruolo di FER nell’ attivazione di MET. Questa scoperta può fornire una nuova strategia per l’intervento terapeutico, forse un farmaco per sopprimere FER che potrà essere somministrato insieme ad un inibitore MET “.
Fonte: EurekAlert