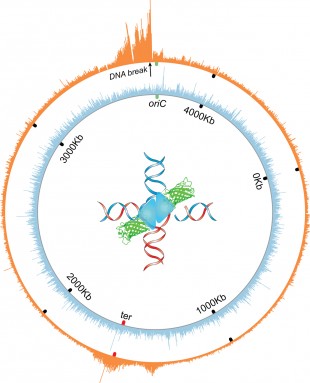
(Cancro-Immagine: la ruota arancione mostra il cromosoma circolare o il genoma dei batteri E. coli. I picchi indicano dove un intermedio molecolare nella riparazione del DNA – giunzioni del DNA a quattro vie – si accumula vicino a una rottura riparabile del doppio filamento nel genoma. Immagine per gentile concessione di Jun Xia e Qian Mei).
Scienziati della Rice University, del Baylor College of Medicine e di altre istituzioni stanno usando la biologia sintetica per catturare frammenti di DNA sfuggenti e di breve durata che le cellule sane producono mentre diventano cancerose.
I ricercatori hanno affermato che il lavoro potrebbe portare allo sviluppo di nuovi farmaci che potrebbero prevenire il cancro neutralizzando gli “intermedi del DNA”, elementi chiave del codice genetico che vengono prodotti quando le cellule sane diventano cancerose.
La ricerca è descritta in un nuovo articolo pubblicato sulla rivista Science Advances.
“Nel mio laboratorio studiamo come il genoma – i geni in un organismo – cambia, in particolare come cambia il genoma delle cellule normali per trasformare le cellule in cellule cancerose”, ha affermato la scienziata capo del progetto Susan Rosenberg, Ben F. Love Chair di Baylor in Cancer Research e leader del Cancer Evolvability Program presso il Dan L Duncan Comprehensive Cancer Center del Baylor.
Quando le cellule si dividono e fanno copie delle istruzioni codificate nel loro DNA, il DNA si svolge e diventa vulnerabile ai danni che devono essere riparati. A volte il processo di riparazione del DNA può anche causare mutazioni ed errori. Quando questi errori si accumulano, le cellule possono acquisire caratteristiche del cancro.
“Il processo di modifica del DNA è svolto da enzimi specifici, proteine che lavorano sul DNA per correggere gli errori”, ha affermato Rosenberg, che è anche Professore a contratto presso il Dipartimento di Bioscienze della Rice.
Secondo Rosemberg, la riparazione del DNA di solito richiede diversi passaggi per essere completata. Tra il DNA originale e il prodotto finale, le cellule producono intermedi di reazione del DNA, che sono cruciali per la reazione ma sono difficili da studiare perché sono presenti solo per una frazione di secondo poiché un enzima catalizza il cambiamento di una molecola in un’altra.
“Le molecole intermedie sono le parti più importanti delle reazioni biochimiche”, ha affermato Rosenberg, che ricopre incarichi nei dipartimenti del Baylor di genetica molecolare e umana, virologia molecolare e microbiologia e biochimica e biologia molecolare. “Le molecole intermedie definiscono qual’è la reazione e come procederà. Ma poiché sono transitorie e sfuggenti, è davvero difficile studiarle, specialmente nelle cellule viventi. Volevamo farlo. Abbiamo deciso di inventare proteine sintetiche che intrappolassero gli intermedi di reazione del DNA nelle cellule viventi”.
Qian Mei, uno studente laureato nel programma Rice’s Systems, Synthetic and Physical Biology e assistente di ricerca nel laboratorio di Rosenberg, ha assunto il compito utilizzare la proteina sintetica in grado di catturare gli intermedi di breve durata. Utilizzando gli strumenti della biologia sintetica, Rosenberg e colleghi hanno creato e aggiunto pacchetti di geni all’Escherichia coli, un organismo che il gruppo di Rosenberg e altri hanno dimostrato essere un modello affidabile dei cambiamenti genetici che si verificano nelle cellule animali.
Anche altri ricercatori hanno tentato di intrappolare gli intermedi, ma sono riusciti solo in alcune reazioni biochimiche.
“Vogliamo usare proteine sintetiche per studiare i meccanismi che cambiano la sequenza del DNA“, ha detto. “Lo facciamo ora con la genetica e la genomica nel mio laboratorio. Ma con la genomica, che ci permette di confrontare i geni delle cellule normali con quelli delle cellule cancerose, è come leggere la documentazione fossile di questi processi. Vogliamo vedere come avvengono i processi che cambiano il DNA in tempo reale , compresi tutti i passaggi intermedi, che le nostre proteine sintetiche ci consentono di congelare nel tempo e isolare”.
Nei loro test su E. coli, Mei, Rosenberg e colleghi di Baylor, dell’Università del Texas ad Austin e dell’MD Anderson Cancer Center dell’Università del Texas hanno scoperto di poter scoprire i meccanismi molecolari alla base dell’instabilità del genoma, un segno distintivo del cancro. In un caso, hanno scoperto un nuovo ruolo per una proteina di E. coli correlata a cinque proteine del cancro umano. Hanno poi analizzato i dati di espressione genica da tumori umani e sono stati in grado di coinvolgere due delle cinque proteine di E. coli – relative alle proteine tumorali umane nella promozione del cancro con un meccanismo simile – non precedentemente implicate.
Vedi anche:Per distruggere il cancro viaggiare indietro nel tempo
“La parte più eccitante di questo articolo per me è che possiamo imparare qualcosa di nuovo sui meccanismi del cancro dal modello di E. coli”, ha affermato Mei, co-primo autore del nuovo articolo. “Anche se i batteri e le cellule umane sono molto diversi, molte proteine di riparazione del DNA sono altamente conservate attraverso l’evoluzione; questo rende E. coli un buon modello per studiare come le cellule riparano il DNA o accumulano mutazioni”.
Rosenberg e colleghi ritengono che il loro approccio offra vantaggi significativi. Ad esempio, con le proteine sintetiche, sono stati in grado di identificare specifiche molecole intermedie di riparazione del DNA, il loro numero nelle cellule, i tassi di formazione e le posizioni nel genoma e le reazioni molecolari a cui partecipano.
“È molto eccitante che ora siamo in grado di intrappolare, mappare e quantificare gli intermedi di reazione del DNA transitorio in singole cellule viventi”, ha affermato il co-primo autore Jun Xia, studente laureato nel laboratorio di Rosenberg e nel programma Integrative Molecular and Biomedical Sciences presso ilBaylor. “Questa nuova tecnologia ci aiuta a rivelare le origini dell’instabilità del genoma”.
“Quando conosci queste reazioni e il ruolo che ogni intermedio gioca nei meccanismi che cambiano il DNA, puoi pensare di creare farmaci che le fermeranno”, ha detto Rosenberg. “In futuro, speriamo di essere in grado di progettare farmaci che prendono di mira specifici tipi di cancro, farmaci che bloccano la capacità delle cellule di evolversi in cellule tumorali, invece o in aggiunta alle chemioterapie tradizionali che uccidono o bloccano le cellule tumorali”.
Altri collaboratori includono Li-Tzu Chen, Chien-Hui Ma, Jennifer Halliday, Hsin-Yu Lin, David Magnan, John Pribis, Devon Fitzgerald, Holly Hamilton, Megan Richters, Ralf Nehring, Xi Shen, Lei Li, David Bates , PJ Hastings, Christophe Herman e Makkuni Jayaram.
La ricerca è stata supportata dalla WM Keck Foundation, dal National Institutes of Health, dalla NASA, dal Cancer Prevention and Research Institute del Texas, dalla National Science Foundation, dalla Welch Foundation, dal Baylor College of Medicine, dal Dan L Duncan Comprehensive Cancer Center e dal John S. Dunn Gulf Coast Consortium for Chemical Genomics.
Fonte: Rice University