(Cancro del pancreas-Immagine: all’interno della piattaforma di vetro di questo vetrino da microscopio, i ricercatori hanno ricreato due strutture anatomiche coinvolte nella diffusione del cancro al pancreas. Credito: foto della Purdue University/John Underwood).
Ciò che rende il cancro del pancreas così mortale è la sua rapida e nascosta diffusione. Ora, una “macchina del tempo” costruita dagli ingegneri della Purdue University ha mostrato un modo per invertire il corso del cancro prima che si diffonda in tutto il pancreas.
“Questi risultati aprono la possibilità di progettare una nuova terapia genica o farmaco perché ora possiamo riconvertire le cellule cancerose nel loro stato normale“, ha affermato Bumsoo Han, Professore di ingegneria meccanica a Purdue e leader del programma del Purdue Center for Cancer Research.
La “macchina del tempo” costruita dal laboratorio di Han è una riproduzione realistica di una struttura pancreatica chiamata acinus che produce e secerne enzimi digestivi nell’intestino tenue. Il cancro del pancreas tende a svilupparsi da un’infiammazione cronica che si verifica quando una mutazione ha causato la digestione da parte di questi enzimi digestivi del pancreas stesso.
Se ci fosse un modo per tornare indietro nel tempo per riprogrammare le cellule cancerose acinose che producono quegli enzimi, allora potrebbe essere possibile ripristinare completamente il pancreas.
Negli ultimi dieci anni, Stephen Konieczny, Professore emerito presso il Dipartimento di Scienze Biologiche di Purdue, ha studiato un potenziale pulsante di ripristino: un gene chiamato PTF1a.
“Il gene PTF1a è assolutamente fondamentale per il normale sviluppo del pancreas. Se ti manca il gene PTF1a, non svilupperai un pancreas”, ha detto Konieczny. “Quindi, la nostra intera idea era, se riaccendiamo il gene PTF1a in una cellula cancerosa del pancreas, cosa succede? Riusciremo a ripristinare il fenotipo del cancro? In effetti, è esattamente ciò che accade”.
Konieczny ha collaborato con il laboratorio di Han per portare questi risultati negli studi di biologia molecolare al livello successivo, testandoli in un modello realistico dell’acino, la macchina del tempo. Lo studio pubblicato è presente sulla copertina del numero del 7 ottobre di Lab on a Chip, una rivista della Royal Society of Chemistry.
I ricercatori in genere studiano possibili approcci terapeutici per il cancro del pancreas in modelli animali, ma possono essere necessari mesi prima che il cancro al pancreas si sviluppi in un animale. Avere un modo per studiare lo sviluppo del cancro e i concetti di trattamento in un microambiente altrettanto realistico farebbe risparmiare tempo e offrirebbe ai ricercatori un maggiore controllo sul modello.
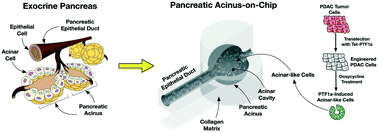
Il modello sviluppato dai ricercatori di Purdue supera un’importante sfida nel catturare con precisione la complessità anatomica dell’acino, una cavità circolare rivestita di cellule.
“Dal punto di vista ingegneristico, creare questo tipo di cavità tridimensionale non è banale. Quindi, trovare un modo per costruire questa cavità è un’innovazione in sé”, ha detto Han.
Il laboratorio di Han aveva già esperienza nella costruzione di un modello realistico di un’altra struttura pancreatica, il dotto, dove il cancro cresce dopo essere emerso dall’acino. I ricercatori hanno preso questa conoscenza e hanno sviluppato una nuova tecnica che costruisce sia il condotto che l’acino in un processo di “diteggiatura viscosa” in due fasi.
Vedi anche:Cancro del pancreas: ruolo dell’obesità nello sviluppo
Ecco come funziona: il modello, una piattaforma di vetro delle dimensioni di un francobollo posta sopra un vetrino da microscopio, ha due camere interconnesse. Il caricamento di una soluzione di collagene in una camera riempie la forma simile a un dito di un dotto pancreatico, che si gonfia e quindi si espande per creare la struttura della cavità dell’acino nella seconda camera. La caduta di cellule umane cancerose nella camera acinare ha reso il modello ancora più realistico. Il laboratorio di Konieczny ha ingegnerizzato il gene PTF1a di una linea cellulare di cancro al pancreas per attivarsi in presenza di doxiciclina, un composto comunemente usato negli antibiotici. Una volta che il gene è stato attivato, le cellule hanno iniziato a costruire il resto dell’acino nel modello di Han, indicando che non erano più cancerose ed erano state riprogrammate.
“In questo modello, non solo le cellule cancerose vengono riprogrammate, ma per la prima volta siamo in grado di mostrare la normale architettura tridimensionale dell’acino, che sembra molto simile alle stesse strutture che vediamo in un pancreas sano“, ha detto Konieczny.
Spiegano gli autori:
“Un acino pancreatico è un’unità funzionale del pancreas esocrino che produce enzimi digestivi. La sua patobiologia è cruciale per le malattie del pancreas, tra cui la pancreatite e il cancro del pancreas, che possono iniziare dagli acini pancreatici. Tuttavia, la ricerca sugli acini pancreatici è stata notevolmente ostacolata a causa della difficoltà di coltivare cellule acinose normali in vitro. In questo studio, un in vitro, il modello dell’acino normale, denominato acinus-on-chip pancreatico (PAC), viene sviluppato utilizzando cellule tumorali pancreatiche riprogrammate. Il modello sviluppato è una piattaforma microfluidica con un dotto epiteliale e una geometria del sacco acinare microfabbricata mediante una tecnica di “diteggiatura viscosa” controllata in due fasi di nuova concezione. In questo modello , vengono coltivate cellule tumorali pancreatiche umane, Panc-1, riprogrammate per tornare allo stato normale dopo l’induzione dell’espressione genica di PTF1a. Analisi bioinformatiche suggeriscono che, in seguito a PTF1a indottaespressione, le cellule Panc-1 passano a un fenotipo acinoso più normale e differenziato. La microanatomia e le funzioni esocrine del modello sono caratterizzate per confermare i normali fenotipi acinosi. Il modello sviluppato fornisce un banco di prova nuovo e affidabile per studiare l’inizio e la progressione dei tumori del pancreas”.
Il laboratorio di Han sta attualmente conducendo esperimenti per esplorare una possibile terapia genica basata su questi risultati.
Fonte: Lab on a Chip