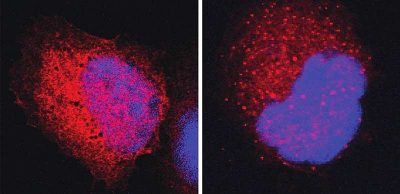
Cancro-Immagine: cellule con proteine p53 cancerogene (in rosso); il materiale genetico nei nuclei cellulari è in blu. A sinistra: in presenza di un normale chaperone DNAJA2, la struttura delle proteine p53 è stabilizzata, quindi non si legano tra loro e rimangono quindi sparse in tutta la cellula. A destra: al contrario, in presenza di una variante DNAJA2 senza “forcina”, le proteine p53 cancerogene formano cluster (punti rossi) che la cellula può riconoscere e distruggere. Credito: Weizmann Institute of Science.
“Chi veglierà sui vigilanti?” chiese il poeta romano Giovenale nel lontano primo secolo d.C. La natura si pone questa domanda da molto, molto più tempo. Il corpo umano contiene proteine progettate per proteggerci dalle escrescenze cancerose.
Come la maggior parte delle proteine, per svolgere correttamente il loro compito, questi “guardiani” devono ripiegarsi in una specifica struttura tridimensionale, e spesso hanno bisogno di una mano per farlo. A proteggere questi guardiani, quindi, ci sono le proteine chaperone, molecole che assicurano che le proteine siano ripiegate correttamente in modo che possano funzionare come dovrebbero.
A volte, le mutazioni genetiche nelle proteine guardiane possono trasformarle da inibitori a promotori del cancro. Incapaci di discernere il cambiamento, le proteine chaperone che le proteggono sfortunatamente forniscono loro la stessa assistenza che danno alle proteine normali.
In un nuovo studio, la Dott. ssa Rina Rosenzweig e il suo team di ricerca presso il Weizmann Institute of Science, hanno scoperto un meccanismo tramite il quale i chaperoni proteggono una proteina con una mutazione cancerosa. Le loro scoperte, pubblicate su Molecular Cell, potrebbero aprire la strada allo sviluppo di nuovi trattamenti mirati contro il cancro.
Una delle famiglie più comuni di chaperoni è la famiglia delle proteine del dominio J (JDP). Negli ultimi decenni, i ricercatori hanno scoperto che ha circa 50 rappresentanti diversi nel corpo umano.
Le loro funzioni includono l’identificazione di proteine che non si sono ripiegate correttamente o in cui la struttura si è sgretolata, e l’invio di queste proteine per essere ripiegate con l’aiuto di altri chaperon. Tra i loro altri compiti, i membri della famiglia JDP aiutano nel ripiegamento della proteina p53, che è nota come “guardiana del genoma”.
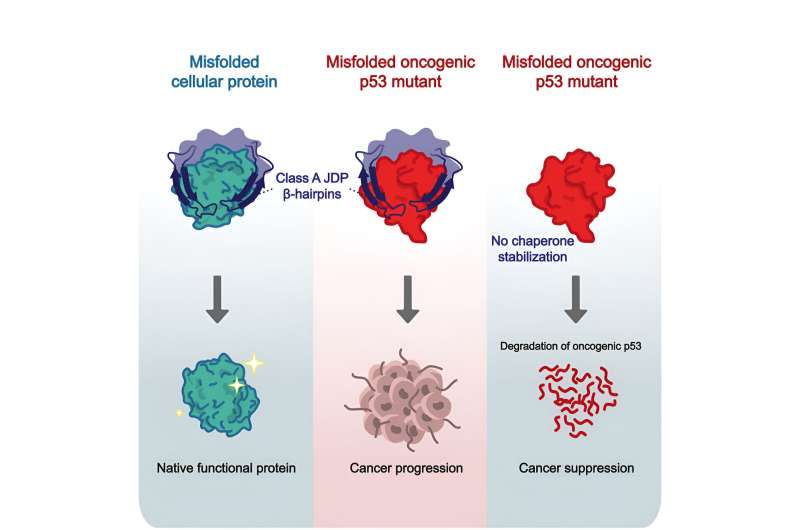
Nella sua forma normale, questo guardiano del genoma inibisce le crescite cancerose, ma piccoli cambiamenti genetici che sostituiscono uno dei suoi amminoacidi costituenti possono indurlo a promuovere il cancro. Studi precedenti hanno dimostrato che i guardiani del guardiano del genoma, ovvero i chaperon, forniscono protezione non solo al p53 correttamente funzionante, ma anche alla sua versione cancerosa.
I chaperoni stabilizzano la struttura instabile delle proteine cancerose e impediscono che aderiscano le une alle altre e formino aggregati disordinati che le cellule normalmente individuerebbero e smantellerebbero, se non ci fosse questo aiuto.
Sembra, quindi, che i chaperon potrebbero essere un buon bersaglio per lo sviluppo di nuove terapie contro il cancro. Tuttavia, poiché forniscono assistenza a una vasta gamma di proteine nella cellula, danneggiare i chaperon potrebbe portare a gravi danni secondari.
I ricercatori del laboratorio di Rosenzweig presso il Dipartimento di Biologia chimica e strutturale, guidati dal Dott. Guy Zoltsman, con la partecipazione di Miriam Kuchersky e della Dott.ssa Ofrah Faust, hanno ipotizzato che lo studio dei membri della famiglia JDP che forniscono assistenza alle versioni cancerose della proteina p53 potrebbe scoprire un nuovo bersaglio per un trattamento mirato del cancro.
Il primo passo è stato identificare esattamente quali membri della famiglia assistono p53 mutato e canceroso. Per farlo, i ricercatori hanno esaminato quattro gruppi di proteine della famiglia JDP che avevano dimostrato di avere un impatto sulla progressione del cancro. Questi esperimenti hanno rivelato che solo le proteine chaperone della Classe A, in particolare una chiamata DNAJA2, aiutavano p53 mutata.
Questi risultati sono stati verificati anche nelle cellule cancerose, grazie a un progetto di ricerca congiunto con il laboratorio del Prof. Bernd Bukau del Centro tedesco per la ricerca sul cancro (DKFZ) di Heidelberg.
Ma come fa DNAJA2 a identificare e proteggere la proteina cancerosa p53?
Utilizzando la tecnologia all’avanguardia della risonanza magnetica nucleare (NMR) presso il Clore Institute for High-Field Magnetic Resonance Imaging and Spectroscopy del Weizmann, i ricercatori sono riusciti a scoprire il meccanismo d’azione di DNAJA2.
La maggior parte delle proteine in una cellula sono create come catene molecolari che si ripiegano in una struttura tridimensionale in cui i componenti amanti dell’acqua si trovano all’esterno della struttura proteica, rivolti verso l’ambiente liquido della cellula, mentre i componenti idrorepellenti si trovano nella parte interna della proteina.
In circostanze normali, identificando le aree idrorepellenti che sono rimaste esposte sulla superficie della proteina, i chaperon riescono a riconoscere una proteina che non si è ripiegata correttamente o che ha perso la sua normale forma tridimensionale.
“A differenza del resto dei chaperon, DNAJA2 si lega a p53 quando è quasi completamente ripiegata“, spiega Rosenzweig. “Si scopre che è in grado di identificare proteine in cui la struttura tridimensionale ha appena iniziato a sfaldarsi, molto prima che intere aree interne siano esposte“.
Utilizzando la NMR, i ricercatori sono stati in grado di analizzare l’interazione tra DNAJA2 e la proteina p53 fino al livello dei singoli atomi. Ciò ha rivelato che sezioni simili a forcine della proteina chaperone, note quindi come β-hairpin (beta hairpin), si attaccano ad aree che sembrano fisarmoniche (note come β-sheet) nel nucleo della proteina bersaglio.
La struttura dei β-sheet è rafforzata dai legami idrogeno, che rimangono stabili per tutta la vita funzionale della proteina. Tuttavia, quando questi legami si allentano, come accade nella versione cancerosa del genome guardian, aumentano il rischio che la proteina si attacchi ad altre proteine.
Ecco dove entrano in gioco le forcine: si legano a queste aree allentate, le stabilizzano e danno loro il tempo di ricostruire i legami idrogeno. Questa protezione offerta alle proteine cancerose impedisce alla cellula di identificarle e di scomporle.
Quando i ricercatori hanno eliminato la ricetta per la forcina dal codice genetico degli chaperon, hanno scoperto che questi ultimi rimanevano funzionali e l’eliminazione aveva danneggiato solo il loro legame con le proteine particolarmente ricche di foglietti a fisarmonica, come p53.
Leggi anche:Il ruolo architettonico di p53 nello sviluppo del cancro
“Dato che l’attività della ‘forcina’ è così focalizzata, sembra che dovremmo essere in grado di sviluppare trattamenti per il cancro prendendo di mira regioni specifiche in chaperoni specifici, senza causare danni significativi al funzionamento delle cellule del corpo“, afferma Rosenzweig. “Il nostro studio presenta il potenziale bersaglio di tali trattamenti, che ridurrebbe l’attività di supporto al cancro di DNAJA2″.