Cancro al seno triplo negativo-Immagine: struttura proteica di MEMO1. Credito: University of Saskatchewan.
Un articolo di ricerca pubblicato di recente su eLife identifica la funzione di una proteina cellulare meno compresa, denominata MEMO1, per il trattamento del cancro al seno triplo negativo. Il Dott. Oleg Dmitriev (Ph.D.), Professore presso il dipartimento di biochimica, microbiologia e immunologia e il Professore di oncologia Dott. Franco Vizeacoumar (Ph.D.) presso la facoltà di medicina dell’USask, sono stati due degli autori dello studio.
Il team ha scoperto che MEMO1 lega il ferro e regola il flusso di ferro nella cellula. E poiché MEMO1 appare ad alti livelli nelle cellule del cancro al seno triplo negativo (TNBC), Dmitriev ha detto che questo potrebbe rendere la regolazione del ferro e la proteina MEMO1, un potenziale bersaglio per i trattamenti contro il cancro.
“L’interesse fondamentale per noi è la regolazione dei metalli nella cellula e il suo ruolo nel cancro”, ha detto Dmitriev. “Sembra che MEMO1 renda le cellule cancerose più sensibili alle interruzioni della distribuzione del ferro, quindi il risultato pratico è che possiamo usare il metabolismo del ferro nella cellula come bersaglio per uccidere le cellule cancerose”.
I ricercatori stanno ancora studiando la funzione primaria della proteina MEMO1 nelle cellule, ma Dmitriev, Vizeacoumar e i loro colleghi, hanno stabilito che essa svolge un ruolo importante nella regolazione del metabolismo del ferro nella cellula o in altre parole, nel traffico di ferro dentro e fuori la cellula e nel modo in cui finisce per essere utilizzato.
MEMO1 è una delle tante proteine coinvolte nell’equilibrio del ferro nella cellula. Ma attraverso un’analisi genomica dettagliata, si possono identificare quali proteine lavorano insieme a MEMO1 e tracciare la rete di interazioni proteiche può portare alla funzione principale di MEMO1 stessa.
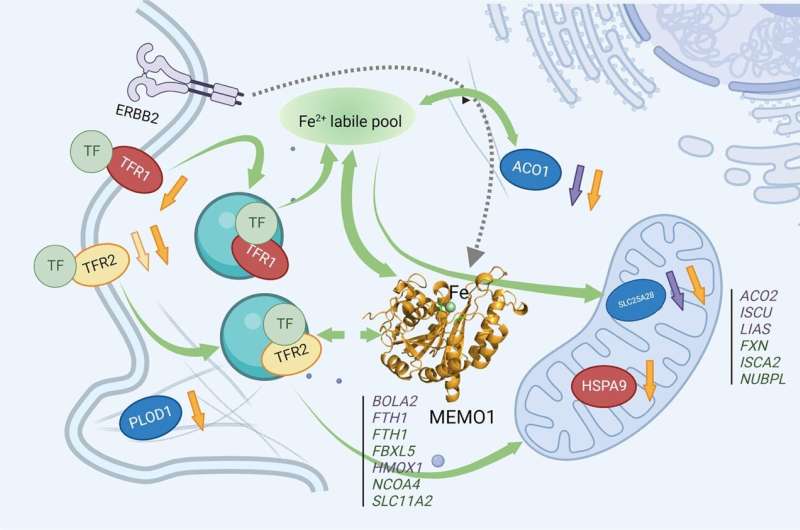
I ricercatori potrebbero quindi creare farmaci che prendono di mira MEMO1 o i suoi partner proteici interagenti e uccidono le cellule che producono alti livelli di MEMO1, come il tumore al seno triplo negativo, interrompendo la loro regolazione del ferro.
Il cancro al seno triplo negativo è uno dei tipi di cancro più aggressivi e difficili da curare, quindi un nuovo possibile bersaglio terapeutico privo degli effetti collaterali della chemioterapia standard potrebbe avere importanti benefici per le pazienti.
“Il problema è che molti farmaci antitumorali sono molto potenti, ma anche terribilmente tossici”, ha detto Dmitriev. “Se riesci a identificare un farmaco che è efficace specificamente nelle cellule che producono grandi quantità di MEMO1, è probabile che tu possa usare quel farmaco a un dosaggio molto più basso per trattare i tumori ad alto contenuto di MEMO1″.
Dmitriev ha elogiato Vizeacoumar e i suoi collaboratori nel progetto, sottolineando le possibilità di combinare conoscenze provenienti da diversi ambiti scientifici per risolvere complessi problemi biomedici.
Leggi anche:Cancro al seno triplo negativo: identificato il sottotipo di cellule staminali che causano la recidiva
Spiegano gli autori:
“MEMO1 è una proteina altamente conservata presente nel citosol delle cellule eucariotiche dal lievito all’uomo. MEMO1 sembra svolgere un ruolo cruciale nella motilità cellulare ed è stata collegata a diversi processi biologici, ma la sua funzione primaria rimane sconosciuta. MEMO1 è stata implicata nei cambiamenti della durata della vita in Caenorhabditis elegans e nei topi, nella regolazione del metabolismo della vitamina D e nello sviluppo delle ossa e del sistema nervoso centrale. Nel contesto del cancro, MEMO1 supporta la capacità delle cellule tumorali del seno di invadere i tessuti circostanti, portando a metastasi. L’abbattimento dell’espressione di MEMO1 riduce la migrazione delle cellule del cancro al seno in coltura e sopprime significativamente le metastasi polmonari in un modello di xenotrapianto. Nell’ambito clinico, l’analisi retrospettiva dei tumori resecati ha mostrato una forte correlazione tra l’aumentata espressione di MEMO1 e la ridotta sopravvivenza del paziente. Questi effetti sono stati collegati all’interazione tra il recettore ERBB2 (HER2) e MEMO1, che a sua volta è stato proposto per trasmettere l’attivazione degli eterodimeri del recettore ERBB al citoscheletro dei microtubuli, inducendo così la crescita dei lamellipodi e consentendo la migrazione delle cellule cancerose. L’interazione con ERBB2 ha dato a MEMO1 il suo nome (m ediator of E RBB2-driven cell mo tility 1). MEMO1 contribuisce anche alla carcinogenesi mammaria attraverso il pathway della proteina substrato del recettore dell’insulina 1 e attraverso l’interazione con il recettore degli estrogeni extranucleari. È stato dimostrato che MEMO1 catalizza reazioni redox dipendenti dal rame, come la produzione di radicali superossido. Ciò ha portato all’idea che MEMO1 sia necessaria per la produzione sostenuta di specie reattive dell’ossigeno (ROS), probabilmente in concomitanza con l’attivazione della NADPH-ossidasi 1. Nel presente lavoro, mostriamo che MEMO1 è una proteina legante il ferro coinvolta nel metabolismo del ferro nella cellula. Il ferro è stato implicato nella carcinogenesi, nella crescita tumorale e nelle metastasi, in particolare nel cancro al seno, da molteplici linee di evidenza, a causa del suo ruolo potenzialmente dirompente nell’equilibrio redox nella cellula e anche a causa dell’elevato fabbisogno di ferro delle cellule tumorali in rapida proliferazione. Pertanto, MEMO1 emerge come un collegamento molecolare diretto tra il metabolismo del ferro e le metastasi nel cancro al seno”.
“È estremamente importante per noi scienziati non isolarci nella nostra torre d’avorio”, ha detto Dmitriev. “Non c’è niente di meglio che parlare con i malati di cancro e con coloro che hanno sconfitto la malattia per comprendere la necessità di nuovi trattamenti”.
Fonte:eLife
