(Cancro al seno-Immagine Credit Public Domain).
L’esaurimento dei livelli di rame può ridurre la produzione di energia di cui le cellule del cancro al seno hanno bisogno per viaggiare e stabilirsi in altre parti del corpo mediante un processo denominato metastasi, secondo un nuovo studio condotto da ricercatori del Weill Cornell Medicine e del Memorial Sloan Kettering Cancer Center ( MSK). La scoperta dei meccanismi sottostanti di come l’esaurimento del rame può aiutare a ridurre le metastasi nel cancro al seno aiuterà a informare la progettazione di futuri studi clinici.
In una serie di documenti di ricerca dal 2013 al 2021, i ricercatori di Weill Cornell Medicine hanno dimostrato che in uno studio clinico di fase II, quando pazienti con carcinoma mammario triplo negativo (TNBC) ad alto rischio sono stati trattati con un farmaco che abbassa i livelli di rame nei loro corpi, ha prolungato il periodo di tempo prima che il loro cancro si ripresentasse e si diffondesse o metastatizzasse. Nell’attuale studio, pubblicato il 15 dicembre su Nature Communications e guidato dalla prima autrice Divya Ramchandani, ricercatrice associata in Chirurgia cardiotoracica presso Weill Cornell Medicine, i ricercatori hanno utilizzato modelli animali per esaminare più da vicino il motivo.
“Una delle caratteristiche distintive del TNBC è che è una forma di malattia altamente aggressiva e difficile da trattare, con un alto tasso di recidiva metastatica e poche opzioni di trattamento”, ha affermato il co-autore senior Dr. Vivek Mittal, Direttore della ricerca presso il Neuberger Berman Lung Cancer Center e il Professore di ricerca Ford-Isom di chirurgia cardiotoracica presso Weill Cornell Medicine. “Anche dopo l’intervento chirurgico e altri trattamenti, i tassi di recidiva sono alti, il che tende a verificarsi precocemente. Di conseguenza, sono necessari trattamenti migliori che si concentrino specificamente su questo tipo di cancro”.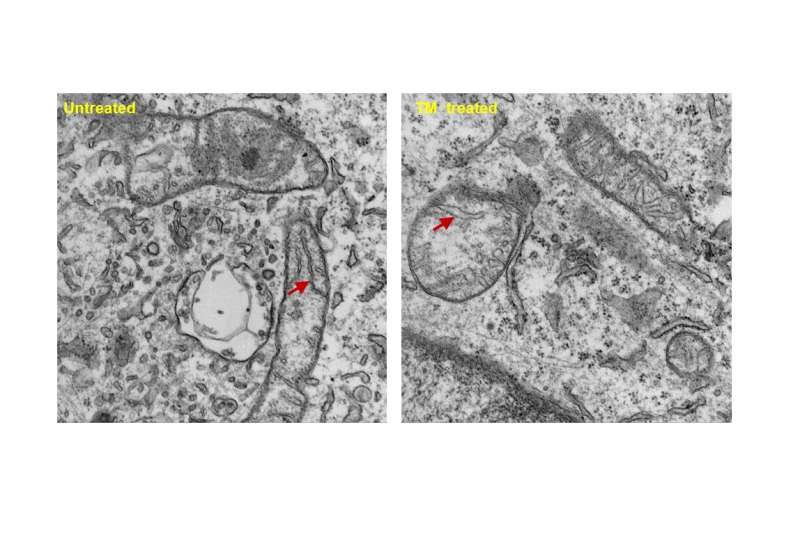 Immagine: immagini di microscopia elettronica a trasmissione che mostrano i cambiamenti mediati dalla TM nelle creste (freccia) all’interno dei mitocondri delle cellule tumorali, che contribuiscono al metabolismo cellulare. Immagine per gentile concessione del Dr. Divya Ramchandani, Juan Pablo Jimenez e Leona Cohen-Gould.
Immagine: immagini di microscopia elettronica a trasmissione che mostrano i cambiamenti mediati dalla TM nelle creste (freccia) all’interno dei mitocondri delle cellule tumorali, che contribuiscono al metabolismo cellulare. Immagine per gentile concessione del Dr. Divya Ramchandani, Juan Pablo Jimenez e Leona Cohen-Gould.
Molti dei processi biologici che avvengono all’interno delle cellule richiedono atomi di metallo. Sebbene il ferro sia forse più noto, il rame ha iniziato a emergere come un attore importante. Il rame è necessario per un processo chiamato fosforilazione ossidativa (OXPHOS), che le cellule usano per generare energia negli organelli chiamati mitocondri. Il Dr. Mittal ha mostrato che le cellule tumorali metastatiche nel TNBC avevano alti livelli di rame intracellulare e livelli elevati di OXPHOS rispetto alle cellule non metastatiche. I ricercatori hanno ipotizzato che le cellule metastatiche potrebbero richiedere molta energia per diffondersi ad altre parti del corpo e, bloccare la disponibilità di rame, interrompendo così la loro fonte di energia, potrebbe essere un buon modo per impedire a queste cellule di viaggiare.
Per abbassare i livelli di rame, i ricercatori sia nel precedente studio clinico che nella recente ricerca sugli animali hanno utilizzato un farmaco chiamato Tetratiomolibdato (TM), che è stato sviluppato per trattare un disturbo da accumulo di rame chiamato malattia di Wilson. Nei modelli murini di TNBC, i ricercatori hanno scoperto che quando si esaurivano i livelli di rame nel corpo, i tumori primari continuavano a crescere mentre la capacità del cancro di metastatizzare veniva notevolmente ridotta.
Uno sguardo più attento alle cellule cancerose trattate con la TM ha scoperto che queste cellule hanno cambiato il loro metabolismo in un modo che ha reso più difficile per loro generare energia. È interessante notare che questa mancanza di stato energetico ha attivato un sensore di energia cruciale, una proteina chinasi attivata dall’AMP (AMPK). In uno studio separato, i ricercatori hanno anche scoperto che l’abbassamento dei livelli di rame ha influito sul rimodellamento del collagene nella cosiddetta nicchia premetastatica, aree del corpo in cui è più facile per le cellule cancerose si stabiliscono. Questo ha aiutato a spiegare come la terapia TM possa rendere più difficile per le cellule TNBC in viaggio colonizzare organi distanti.
“Questo documento si basa su una ricerca clinica, che abbiamo riportato in laboratorio”, ha affermato la co-autrice senior Dr. Linda Vahdat, Professore di medicina presso Weill Cornell Medicine, oncologo medico presso MSK e capo del oncologia medica e Direttore clinico dei servizi oncologici presso il Norwalk Hospital. “Ora l’ipotesi si è trasformato in una scienza molto interessante che possiamo portare avanti in una sperimentazione clinica più ampia”.
Vedi anche:Cancro al seno triplo negativo: efficace farmaco riproposto
“Possiamo utilizzare queste informazioni per pianificare il nostro ampio studio randomizzato sul cancro al seno”, ha affermato il Dott. Mittal. Lo studio, che sarà uno studio di fase II che arruola 177 pazienti, esaminerà l’uso di TM come trattamento adiuvante (uno somministrato dopo il completamento dell’altro trattamento) per ridurre il rischio di recidiva del cancro nei pazienti con TNBC. Lo studio dovrebbe iniziare a reclutare pazienti nell’autunno del 2022 attraverso il Translational Breast Cancer Research Consortium, supportato dalla Breast Cancer Research Foundation, con il supporto aggiuntivo del programma NCI NExT.
“Nello studio precedente”, ha affermato il Dott. Vahdat, “le pazienti avevano pochissimi effetti collaterali da TM, che viene assunta due o tre volte al giorno come pillola. “Noi impoveriamo il rame nei pazienti al livello in cui le normali funzioni cellulari possono ancora svolgersi, ma i processi legati al tumore non possono”, ha detto.
La ricerca di laboratorio sarà una componente importante dell’imminente studio in quanto l’obiettivo è quello di individuare il trattamento giusto per il paziente giusto al momento giusto. I ricercatori studieranno i tessuti dei pazienti per analizzare gli aspetti metabolici sia del tumore che dei tessuti sani. Il Dott. Mittal e Vahdat hanno in programma di espandere questi risultati utilizzando una sovvenzione di $ 2,8 milioni recentemente assegnata dal National Cancer Institute per studiare la riprogrammazione metabolica mediata dal rame e le alterazioni della matrice extracellulare nelle metastasi TNBC.
Fonte:Nature