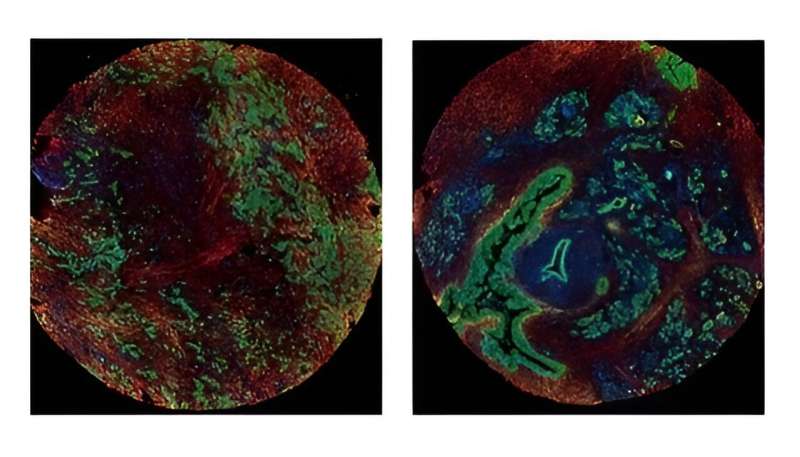
Immagine: il modello della cicatrice suggerisce la durata della vita dopo una diagnosi di cancro al pancreas. Le ghiandole pancreatiche di sinistra (verdi) sono annidate all’interno di fibre cicatriziali ispessite simili a cavi (rosse, gialle), un modello associato a una sopravvivenza più breve. Esatto, le ghiandole intatte sono incorporate in fibre simili a fusi, suggerendo una durata di vita più lunga. Credito: Jason Guo-
Secondo un nuovo studio condotto da ricercatori della Stanford Medicine, il tessuto cicatriziale che si forma attorno al cancro al pancreas in crescita chiamato adenocarcinoma duttale pancreatico contiene preziosi indizi sulla durata della vita delle persone affette da questi tumori.
L’architettura e l’organizzazione delle cellule nel tessuto cicatriziale possono essere utilizzate per classificare i pazienti in due gruppi. I membri di un gruppo vivevano in media quasi due anni in più rispetto ai membri dell’altro gruppo: una differenza sostanziale per un cancro con un tasso di sopravvivenza a cinque anni dopo l’intervento chirurgico solo dal 20% al 25%.
In effetti, i ricercatori hanno scoperto che i modelli del tessuto cicatriziale di un paziente sono tra gli elementi prognostici più predittivi per questo tipo di cancro, secondi solo allo stadio del tumore al momento della diagnosi.
La scoperta suggerisce che le cellule del tessuto cicatriziale, così come la sua struttura complessiva, interagiscono con le cellule tumorali per innestare o frenare la loro crescita. I farmaci che intercettano i messaggi a favore della crescita o imitano le conversazioni cellulari che scoraggiano la crescita, possono portare a nuove strade terapeutiche.
“Il nostro studio mette sul tavolo nuovi approcci terapeutici”, ha affermato il Professore di chirurgia Michael Longaker, MD. “Dovremmo trattare non solo il tumore, ma anche il tessuto cicatriziale? Direi di sì. Entrambi ovviamente svolgono un ruolo nell’esito del paziente“.
Longaker, Professore del Deane P. e Louise Mitchell presso la School of Medicine, è l’autore senior dello studio, che è stato pubblicato nel numero del 21 novembre di Cell Reports Medicine. Lo studioso post-dottorato Jason Guo, Ph.D. e l’ex studente ora laureato Shamik Mascharak, MD, Ph.D., sono gli autori principali della ricerca.
Morti in aumento
Le morti per adenocarcinoma duttale pancreatico, il tipo più comune di cancro al pancreas, “sono in aumento e si prevede che diventerà la seconda causa di morte per cancro nei prossimi 10 anni”. Poiché la malattia metastatizza o invade altre parti del corpo in modo precoce e rapido, spesso recidiva entro due anni dal trattamento iniziale.
L’adenocarcinoma duttale pancreatico innesca una risposta particolarmente forte da parte delle cellule chiamate fibroblasti presenti nel tessuto connettivo che circonda il pancreas. “I fibroblasti secernono collagene e altri componenti della cosiddetta matrice extracellulare per legare il tumore in una rete di tessuto cicatriziale associato al cancro chiamata desmoplasia. Ricerche precedenti avevano suggerito che questo tessuto cicatriziale influenzasse la prognosi del paziente, ma le analisi si limitavano principalmente a semplici misurazioni quantitative”, spiegano gli autori.
“Studi precedenti si sono concentrati sulle cellule tumorali stesse o sulla quantità di fibrosi o cicatrici che circonda il tumore”, ha detto Guo. “Ma i nostri risultati rivelano che forse l’informazione critica non deriva dalla quantità o dalla massa del tessuto cicatriziale, ma dai suoi componenti interni e dalla sua organizzazione”.
Guo e i suoi colleghi hanno studiato centinaia di campioni di tessuto di adenocarcinoma duttale pancreatico raccolti durante un intervento chirurgico per rimuovere la porzione cancerosa del pancreas, un trattamento standard per la condizione. Hanno utilizzato un algoritmo informatico per identificare e analizzare quasi 300 attributi distinti della desmoplasia, tra cui la lunghezza, la larghezza, l’allineamento e la densità delle fibre e un’altra tecnica chiamata CODEX per valutare la prevalenza e la posizione delle cellule immunitarie e di altro tipo nel sistema immunitario.
I risultati hanno effettivamente permesso ai ricercatori di ingrandire per ottenere una visione cellulare di chi è fianco a fianco con chi (e quanto sono stretti insieme) rispetto ad altri che si scambiano saluti amichevoli in una stanza affollata. I ricercatori rano particolarmente interessati a studiare le interazioni tra le cellule immunitarie chiamate cellule B e T e i fibroblasti specializzati associati al cancro che promuovono l’infiammazione.
Modelli di sopravvivenza
I ricercatori hanno quindi utilizzato un approccio di apprendimento automatico per combinare i dati sulle molteplici interazioni cellulari e sull’architettura delle fibre con le informazioni cliniche su ciascun paziente per scoprire modelli specifici associati alla sopravvivenza globale nei mesi e negli anni successivi alla diagnosi iniziale. Hanno scoperto che la “presenza di un tipo specifico di cellula T chiamata cellula T citotossica era fortemente associata a una sopravvivenza globale più lunga, mentre l’abbondanza di cellule tumorali che modulano il sistema immunitario, così come le cellule B attivate, erano associate a una sopravvivenza più scarsa”.
“Nelle nostre analisi sono emersi anche fibroblasti pro-infiammatori, cosa che siamo stati felici di vedere“, ha detto Guo. “Eliminare questi fibroblasti o inibire la loro attività è un potenziale bersaglio per nuove terapie. Abbiamo anche osservato strette relazioni tra le cellule B e questi fibroblasti, il che è interessante. Di cosa stanno parlando? Ci piacerebbe approfondire e vedere tra quali cellule vengono scambiati segnali“.
I ricercatori hanno anche scoperto che le fibre più sottili predicevano una sopravvivenza migliore rispetto alle fibre robuste e densamente addensate trovate nei campioni di pazienti morti subito dopo la diagnosi.
Una volta incorporati tutti i dati, i computer sono stati in grado di classificare i pazienti con carcinoma duttale pancreatico in due gruppi principali. I pazienti di un gruppo hanno vissuto in media 655 giorni in più rispetto all’altro.
Longaker, Guo e i loro colleghi sperano che le nuove informazioni sui contributi della desmoplasia alla crescita del cancro al pancreas non solo aprano le porte a nuove terapie, ma che vengano anche utilizzate per guidare le decisioni cliniche.

Astratto Grafico Credito Cell Reports Medicine.
Riepilogo
“Si prevede che l’adenocarcinoma duttale pancreatico (PDAC) diventi la seconda causa di morte correlata al cancro. Le caratteristiche distintive includono la desmoplasia con architettura variabile della matrice extracellulare (ECM) e un microambiente complesso con popolazioni tumorali, stromali e immunitarie spazialmente definite. Tuttavia, il ruolo dell’organizzazione spaziale desmoplastica nella variabilità paziente/tumore rimane sottoesplorato, che noi chiariamo utilizzando due tecnologie. Innanzitutto, quantifichiamo il pattern ECM in 437 pazienti, rivelando architetture associate alla sopravvivenza libera da malattia e globale. In secondo luogo, profiliamo spazialmente l’ambiente cellulare di 78 campioni utilizzando la codetection mediante indicizzazione, identificando un asse di interazioni cellulari pro-infiammatorie predittivo di risultati peggiori. Scopriamo che le caratteristiche cliniche, tra cui lo stato della chemioterapia neoadiuvante, lo stadio del tumore e l’architettura dell’ECM, sono correlate con l’organizzazione differenziale stromale-immune, compresi i sottotipi di fibroblasti con nicchie distinte. Infine, definiamo firme unificate che predicono la sopravvivenza, differenziando la sopravvivenza di 655 giorni. Nel complesso, i nostri risultati stabiliscono organizzazioni ultrastrutturali e cellulari della matrice della fibrosi legate a risultati peggiori”.
“In futuro, immagino che un paziente venga sottoposto a una biopsia prima dell’inizio del trattamento e i medici esamineranno non solo il cancro, ma anche i modelli e i tipi di cellule nella desmoplasia“, ha detto Longaker.
Leggi anche:Cancro al pancreas: nuovo approccio promettente
“Ciò potrebbe anche aiutare i medici a decidere quali pazienti avranno probabilmente bisogno di una terapia più aggressiva nelle fasi iniziali della malattia e a chi potrebbero essere risparmiate la chemioterapia o le radiazioni invasive o aggressive. Spero che potremo sviluppare un approccio chemioterapico che non si concentri solo sul cancro, ma ciò influisca anche sui fibroblasti e sul loro ruolo nel promuovere la crescita del tumore”.
Fonte:Cell Reports Medicine
