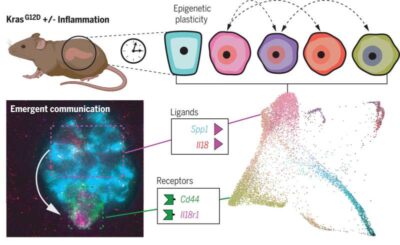
Cancro al pancreas-Immagine: una lente sulla plasticità epigenetica e le sue conseguenze sulla tumorigenesi. Un modello di topo geneticamente modificato ha consentito una visione longitudinale degli stati cellulari nella progressione precoce del cancro al pancreas, rivelando la plasticità fornita dall’innesco epigenetico. Gli stati delle cellule plastiche esprimono insiemi distinti di geni di comunicazione coinvolti nella comunicazione specifica della tumorigenesi, come visualizzato dall’imaging altamente multiplexato. L’illustrazione è stata creata con BioRender. Credito: Scienza (2023).
Secondo una nuova ricerca, l’espansione della comunicazione cellula-cellula guida lo sviluppo precoce del cancro al pancreas.
Le discussioni sul cancro spesso sottolineano le mutazioni genetiche che guidano la malattia alterando la normale funzione delle proteine cellulari. KRAS, ad esempio, normalmente funge da interruttore on/off per la proliferazione cellulare, ma le mutazioni del gene, comuni nel cancro del polmone, del colon-retto e del pancreas, fanno sì che quell’interruttore rimanga attivo.
Eppure le mutazioni sono solo metà della storia.
Le interazioni tra queste mutazioni genetiche e fattori esterni, come le lesioni tissutali che portano all’infiammazione, rimodellano le identità delle cellule e il loro ambiente locale in modi che favoriscono l’emergenza del cancro e la crescita incontrollata.
Nel cancro del pancreas, questi cambiamenti iniziano ad avvenire rapidamente, entro 24-48 ore dal danno tissutale. Accadono prevedibilmente e ampliano notevolmente la capacità di alcune cellule di comunicare e interagire con le cellule vicine.
Questi sono i risultati di un nuovo studio pubblicato l’11 maggio su Science da un gruppo di ricerca internazionale guidato dai ricercatori dello Sloan Kettering Institute presso il Memorial Sloan Kettering Cancer Center (MSK) e dell’IRB di Barcellona. La ricerca ha combinato sofisticati modelli murini geneticamente modificati e metodi computazionali avanzati per mappare i primi stati cellulari che portano all’adenocarcinoma duttale pancreatico (PDAC), il tipo più comune di cancro al pancreas.
Sebbene il tasso di sopravvivenza a cinque anni per il cancro al pancreas sia aumentato negli ultimi anni, rimane piuttosto basso, solo il 12%, secondo il Pancreatic Cancer Action Network. La malattia di solito non viene diagnosticata fino a quando il cancro non è in fase avanzata ed è la terza causa di morte correlata al cancro.
La ricerca mirava non solo a far luce sugli eventi cellulari precoci difficili da studiare che danno origine al cancro al pancreas, ma anche a trovare potenziali opportunità di intervento medico nelle prime fasi della malattia.
Come la plasticità guida il cancro
“La capacità delle cellule di abbandonare la loro identità originale e adattarsi è chiamata plasticità. E questa plasticità è migliorata dall’infiammazione“, hanno scoperto i ricercatori.
“Queste cellule precancerose acquisiscono la capacità di inviare e ricevere molti più segnali rispetto a una cellula normale”, afferma la biologa computazionale Dana Pe’er, Ph.D., uno dei due autori senior del documento. “E abbiamo visto che questo non è casuale, è strutturato. Vedi gli stessi schemi emergere più e più volte quando esegui gli esperimenti su topi diversi“.
Lo studio è stato condotto dai co-primi autori Cassandra Burdziak, dottoranda nel Pe’er Lab e Direna Alonso-Curbelo, Ph.D., un ex membro del laboratorio del co-autore senior Scott Lowe, Ph.D. ., che ora dirige il proprio laboratorio all’IRB di Barcellona.
Per studiare le origini e gli impatti della plasticità sulle cellule che esprimono una versione mutata di KRAS, gli scienziati hanno eseguito analisi a cellula singola su tessuti normali, infiammati, precancerosi e maligni utilizzando un modello murino geneticamente progettato per ricreare accuratamente molti aspetti del cancro del pancreas negli esseri umani, dai suoi primi inizi alla metastasi.
“Questi modelli ci hanno permesso di catturare i primi cambiamenti nelle cellule epiteliali pancreatiche mentre progredivano da uno stato sano verso uno stato maligno“, afferma il Dott. Lowe, ricercatore dell’Howard Hughes Medical Institute e Presidente del Cancer Biology and Genetics Program presso lo Sloan Istituto Kettering. Le analisi a cellula singola hanno permesso ai ricercatori di distinguere le caratteristiche delle sottopopolazioni di singole cellule all’interno del pancreas in ogni fase della progressione e in che modo le loro interazioni guidano ulteriormente la progressione.
“Questo progetto ha richiesto una quantità significativa di innovazione computazionale, la maggior parte guidata da Cassandra”, osserva Pe’er, che è anche ricercatore dell’Howard Hughes Medical Institute e che dirige il programma di biologia computazionale e dei sistemi presso lo Sloan Kettering Institute. “Abbiamo dovuto inventare una serie di nuovi metodi per rispondere a domande che in genere non vengono poste sulla plasticità, sulla comunicazione da cellula a cellula e sulla progressione del tumore“.
Ad esempio, il team ha inventato un nuovo punteggio di classificazione per misurare la plasticità di una cellula. Ha anche scoperto che una maggiore plasticità ha portato al potenziamento dei geni legati alla comunicazione cellula-cellula: come quelli che codificano ligandi e recettori.
“Fondamentalmente, questi sono geni che consentono alle cellule di inviare e ricevere segnali dal suo ambiente e con altre cellule”, afferma Pe’er. “Questo dà alla cellula la capacità di rispondere a segnali che una cellula normale non sarebbe in grado di fare. Hanno anche una maggiore capacità di comunicare con le cellule immunitarie e, di conseguenza, il sistema immunitario attorno a queste cellule inizia a cambiare“.
Inoltre, i ricercatori sono stati in grado di determinare che alcune sottopopolazioni di cellule, alcune delle quali piuttosto rare, si trasformano in importanti snodi di comunicazione, guidando un ciclo di feedback che porta allo sviluppo e alla progressione del cancro al pancreas.
Lo studio rappresenta il culmine della ricerca avviata dal Dr. Alonso-Curbelo, che ha un interesse di lunga data nel dettagliare il meccanismo molecolare attraverso il quale l’infiammazione promuove l’insorgenza del cancro.
“Questo lavoro è stato una vera collaborazione tra scienza sperimentale e scienza computazionale”, afferma il Dott. Alonso-Curbelo.
Vedi anche:Cancro al pancreas: identificati segni distintivi per la terapia
I modelli computazionali sono stati convalidati con esperimenti di follow-up. “Ad esempio, l’imaging ci ha mostrato che le popolazioni di cellule che secondo i metodi computazionali parlavano tra loro erano significativamente più vicine l’una all’altra nel tessuto”, afferma Burdziak. Attraverso ulteriori esperimenti, il team è stato in grado di dimostrare che queste conversazioni guidano lo sviluppo del cancro.
“Abbiamo sviluppato nuovi modelli murini per bloccare in modo specifico la segnalazione da cellula a cellula associata alla plasticità neoplastica“, afferma il Dott. Alonso-Cuurbelo. “Queste analisi hanno mostrato che queste estese reti di comunicazione dirigono la formazione del tumore pancreatico nei topi”.
Verso applicazioni cliniche
Nel complesso, la ricerca fornisce una nuova e dettagliata comprensione di come le cellule che trasportano una copia mutata del gene KRAS acquisiscono plasticità e guidano la progressione del cancro quando sono sottoposte a infiammazione.
“Questo fornisce una tabella di marcia che può aiutare a sviluppare strategie per rilevare o forse anche prevenire i tumori pancreatici prima che raggiungano uno stadio incurabile”, afferma il Dott. Lowe. “E capire come le reti di comunicazione cellula-cellula guidano l’inizio del cancro al pancreas è promettente per lo sviluppo di terapie per bloccare o rallentare la progressione precoce del cancro e persino malattie potenzialmente più avanzate“.
Fonte:Science