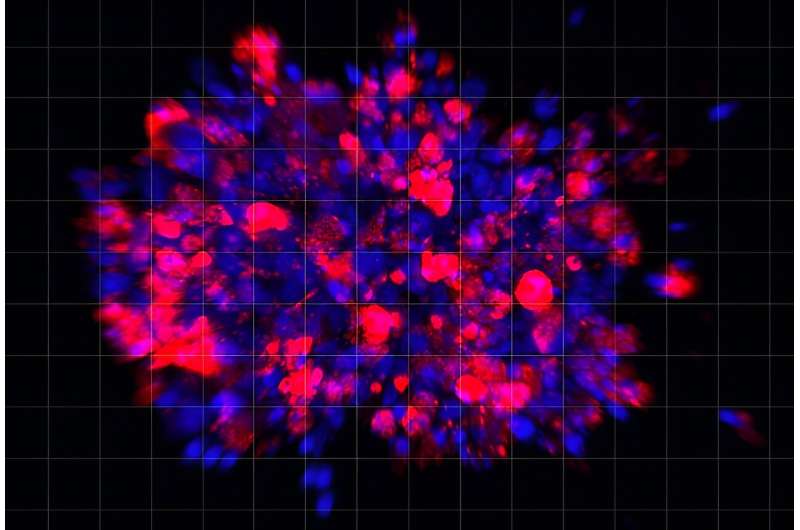
Immagine: la peresilina maleato induce la morte cellulare degli organoidi del cancro del pancreas umano. (Rosso: indicatore di morte cellulare; Blu: DAPI). Credito: Xiaohua Duan.
Secondo un nuovo studio condotto da ricercatori della Weill Cornell Medicine, un sistema di screening farmacologico che modella i tumori utilizzando tessuti coltivati in laboratorio chiamati organoidi ha contribuito a scoprire un obiettivo promettente per futuri trattamenti contro il cancro al pancreas.
Nello studio, pubblicato il 26 dicembre su Cell Stem Cell, gli scienziati hanno testato più di 6.000 composti sui loro organoidi tumorali del pancreas che contengono una comune mutazione che guida il cancro al pancreas. Hanno identificato un composto, un farmaco per il cuore esistente chiamato peresilina maleato, che sopprime potentemente la crescita degli organoidi.
I ricercatori hanno scoperto che la mutazione che provoca il cancro negli organoidi provoca una produzione anormalmente elevata di colesterolo, che il farmaco inverte in gran parte.
“I nostri risultati identificano la sintesi iperattiva del colesterolo come una vulnerabilità che può essere individuata nella maggior parte dei tumori del pancreas“, ha affermato il co-autore senior dello studio, il Dottor Todd Evans, vicePresidente per la ricerca in chirurgia, Professore MD di Chirurgia Peter I. Pressman e un membro dell’Hartman Institute for Therapeutic Organ Regeneration presso Weill Cornell Medicine.
“Questo studio evidenzia anche il valore dell’utilizzo di organoidi geneticamente ben definiti per modellare il cancro e scoprire nuove strategie di trattamento“, ha affermato il co-autore senior Dr. Shuibing Chen, Direttore del Center for Genomic Health, Professore di chirurgia della famiglia Kilts e membro dell’Istituto Hartman per la rigenerazione terapeutica degli organi presso la Weill Cornell Medicine.
Un sistema di screening basato sugli organoidi tumorali
Gli organoidi sono diventati strumenti popolari per studiare i tessuti sani e malati. Possono essere realizzati con tessuti umani o animali, possono ricreare gran parte della complessa architettura di un organo e possono essere geneticamente modificati per la modellazione di precisione. Gli organoidi possono anche modellare specifici tipi di tumore con le loro mutazioni genetiche che causano il cancro. Infatti, quando questi organoidi tumorali derivano da tessuti umani, hanno il potenziale per modellare i tumori umani meglio di qualsiasi modello animale.
Nello studio, i ricercatori hanno creato un sistema automatizzato di screening farmacologico basato su organoidi per la forma più comune di cancro del pancreas, l’adenocarcinoma duttale pancreatico (PDAC), uno dei tumori più incurabili e letali. Gli organoidi, costituiti da normale tessuto pancreatico di topo, sono stati progettati per contenere vari insiemi di mutazioni note per provocare tumori pancreatici umani. Tutti gli organoidi contenevano KrasG12D, la versione murina di un gene mutante che provoca il cancro trovato nella maggior parte dei casi di PDAC.
I ricercatori hanno testato sugli organoidi una serie di oltre 6.000 composti, inclusi farmaci approvati dalla FDA, identificandone diversi che potrebbero interromperne sostanzialmente la crescita del cancro. Il migliore di questi era la Peresilina Maleato, un vecchio farmaco usato per trattare la condizione cardiaca chiamata angina. Una modesta dose del farmaco ha bloccato la crescita di tutti gli organoidi contenenti KrasG12D, distruggendone alcuni in pochi giorni, senza avere alcun impatto negativo sugli organoidi sani privi della mutazione. Il farmaco ha avuto effetti simili contro gli organoidi tumorali derivati dal PDAC umano e trapiantati nei topi e sugli organoidi tumorali umani portatori di altri tipi di mutazione di Kras.
Confrontando i modelli di attività genetica negli organoidi trattati e non trattati, i ricercatori hanno scoperto che il mutante Kras associato al cancro aumenta notevolmente la produzione di colesterolo nelle cellule organoidi e che la Peresilina Maleato si oppone a questo effetto inibendo un fattore chiave di regolazione della via metabolica del colesterolo chiamato SREBP2.
Colesterolo come bersaglio emergente del cancro
La scoperta del ruolo del colesterolo non è stata del tutto sorprendente, poiché il colesterolo è un elemento essenziale utilizzato per creare nuove cellule e un promotore della sopravvivenza cellulare; è già noto per essere un importante sostenitore della crescita maligna di alcuni altri tumori, compresi i tumori polmonari. Ora, i risultati suggeriscono che prenderlo di mira potrebbe essere una nuova strategia di trattamento efficace contro il PDAC.
L’efficacia della Peresilina Maleato negli organoidi umani che ospitano diverse mutazioni di Kras suggerisce anche che la sintesi turbo del colesterolo può essere un obiettivo terapeutico generale nei tumori con mutazioni di KRAS.
“Speriamo che la nostra strategia di target del colesterolo sia indipendente da particolari mutazioni di KRAS e renda difficile per i tumori trattati sviluppare resistenza“, ha affermato il Dottor Evans, che è anche membro del Sandra and Edward Meyer Cancer Center.
È improbabile che la Peresilina Maleato venga utilizzata così com’è per il trattamento del PDAC. Sebbene sia ancora prescritto come farmaco contro l’angina in Australia e in alcuni altri paesi, può avere gravi effetti collaterali, tra cui danni al fegato e ai nervi periferici, motivo per cui è stato ritirato da diversi mercati europei negli anni ’80 e non è mai stato approvato negli Stati Uniti.
Leggi anche:Cancro al pancreas: avanza la conoscenza sullo sviluppo delle metastasi
“Vogliamo un composto migliore per il trattamento del cancro“, ha affermato il Dottor Chen. “La semplicità della struttura chimica del farmaco suggerisce che probabilmente può essere modificato per migliorarne la potenza, la sicurezza, l’emivita nel sangue e altre proprietà”, ha affermato.
Il team ora prevede di utilizzare la Peresilina Maleato come punto di partenza per lo sviluppo di un farmaco candidato contro il PDAC, più raffinato e come strumento di laboratorio per studiare la sintesi del colesterolo nel PDAC e in altri tumori.
Fonte:Cell Stem Cell