Cancro al fegato-Immagine Credit Public Domain-
Gli scienziati del National Institutes of Health e del Massachusetts General Hospital di Boston hanno scoperto un potenziale nuovo approccio contro il cancro al fegato che potrebbe portare allo sviluppo di una nuova classe di farmaci antitumorali. In una serie di esperimenti su cellule e topi, i ricercatori hanno scoperto che un enzima prodotto nelle cellule tumorali del fegato potrebbe convertire un gruppo di composti in farmaci antitumorali, uccidendo le cellule e riducendo la malattia negli animali.
I ricercatori suggeriscono che questo enzima potrebbe diventare un potenziale bersaglio per lo sviluppo di nuovi farmaci contro i tumori del fegato e forse anche altri tumori e malattie.
“Abbiamo trovato una molecola che uccide le cellule in un raro cancro al fegato in un modo unico“, ha detto lo scienziato traslazionale Matthew Hall, Ph.D., uno dei leader del lavoro presso il National Center for Advancing Translational Sciences (NCATS) del NIH. “È emersa da uno screening per trovare molecole che uccidono selettivamente le cellule tumorali del fegato umano. Ci è voluto molto lavoro per capire che la molecola viene convertita da un enzima in queste cellule tumorali del fegato, creando un farmaco antitumorale tossico“.
Hall, Nabeel Bardeesy, Ph.D., uno specialista del cancro al fegato presso il Massachusetts General Hospital e i loro colleghi hanno riportato i loro risultati il 13 marzo su Nature Cancer.
La scoperta nasce da una collaborazione tra i ricercatori del Massachusetts General Hospital e NCATS. Bardeesy stava originariamente studiando il colangiocarcinoma, un tipo di cancro al fegato che colpisce il dotto biliare. Il cancro è caratterizzato da mutazioni nell’enzima IDH1. Il team di Bardeesy voleva trovare composti e farmaci che potessero essere efficaci contro la mutazione IDH1. Attraverso una collaborazione con NCATS, Hall e altri scienziati NCATS hanno rapidamente testato migliaia di farmaci approvati e agenti cancerogeni sperimentali per la loro efficacia nell’uccidere le cellule di colangiocarcinoma, con IDH1 come bersaglio.
Hanno scoperto che diverse molecole, tra cui una chiamata YC-1, potrebbero uccidere le cellule tumorali. Tuttavia, quando hanno cercato di vedere come funzionava YC-1, hanno scoperto che il composto non stava influenzando la mutazione IDH1.
I ricercatori del Massachusetts hanno dimostrato che le cellule tumorali del fegato producono un enzima, SULT1A1. L’enzima ha attivato il composto YC-1, rendendolo tossico per le cellule tumorali nelle colture di cellule tumorali e nei modelli murini di tumori del fegato. Nei modelli animali trattati con YC-1, i tumori del fegato avevano una crescita ridotta o si erano ridotti. Al contrario, i ricercatori non hanno riscontrato cambiamenti nei tumori trattati con YC-1 negli animali con cellule tumorali prive dell’enzima.
I ricercatori hanno esaminato altri database di risultati di screening dei farmaci in elenchi di composti e farmaci per abbinare l’attività del farmaco con l’attività SULT1A1. Hanno anche esaminato un ampio database di composti antitumorali del National Cancer Institute per ulteriori possibilità di testare la loro attività con l’enzima.
Hanno identificato diverse classi di composti che si basavano su SULT1A1 per la loro attività antitumorale. Utilizzando metodi computazionali, hanno previsto altri composti che probabilmente dipendevano anche da SULT1A1.
Vedi anche:Cancro al fegato aggressivo: una graffetta molecolare una delle cause
“Una volta che abbiamo trovato che SULT1A1 attiva YC-1, ci siamo chiesti: ‘Quali altri composti sono attivi e possono uccidere le cellule con lo stesso meccanismo?’ “, ha detto Hall. “Possiamo identificare altri composti che erano in fase di sviluppo e dimostrare che erano attivi anche a causa dell’attivazione di SULT1A1? La risposta è stata sì. Abbiamo trovato altri composti con lo stesso meccanismo d’azione di YC-1“.
Gli scienziati suggeriscono che questi risultati hanno implicazioni più ampie per lo sviluppo di nuovi farmaci antitumorali. “Pensiamo che queste molecole abbiano il potenziale per essere una classe non sfruttata di farmaci antitumorali che dipendono da SULT1A1 per la loro attività contro i tumori”, ha detto Bardeesy.
I ricercatori vedono YC-1 e molecole simili come prototipi per lo sviluppo di composti che potrebbero essere efficaci contro importanti proteine sulle cellule. La modifica di diverse parti di queste molecole potrebbe renderle più specifiche per tali proteine. I ricercatori indicano la creazione di un “toolkit di molecole attivate da SULT1A1” che potrebbe influenzare molti obiettivi diversi.
Abstract:
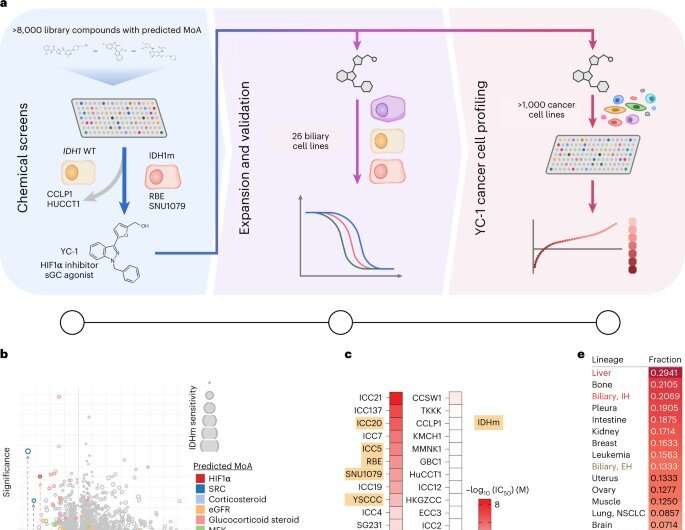
Immagine: schema degli studi di screening e validazione dei farmaci; MoA, meccanismo d’azione.
Tale toolkit è composto da centinaia di molecole note. In teoria, il toolkit copre molti tipi di enzimi, chiamati sulfotransferasi, che sono attivi in diversi tessuti del corpo. Ad esempio, oltre a SULT1A1, nel cervello è attiva la sulfotransferasi umana SULT4A1. Può attivare un sottoinsieme delle molecole nel toolkit. Questo potrebbe essere utile nello sviluppo di farmaci specifici per i tumori cerebrali.
Spiegano gli autori:
“Le neoplasie epatiche dell’adulto, tra cui il colangiocarcinoma intraepatico e il carcinoma epatocellulare, sono la seconda causa di morte correlata al cancro in tutto il mondo. La maggior parte delle persone viene trattata rispettivamente con chemioterapia combinata o immunoterapia, senza biomarcatori specifici per la selezione. Qui utilizzando schermi ad alto rendimento, proteomica e modelli di resistenza in vitro, identifichiamo la piccola molecola YC-1 come selettivamente attiva contro un sottoinsieme definito di linee cellulari derivate da entrambi i tipi di cancro al fegato. Dimostriamo che la selettività è determinata dall’espressione dell’enzima sulfotransferasi citosolico residente nel fegato SULT1A1. La solfonazione stimola il legame covalente di YC-1 ai residui di lisina nei bersagli proteici, arricchendo i fattori di legame dell’RNA. L’analisi computazionale ha definito un gruppo più ampio di piccole molecole strutturalmente correlate attivate da SULT1A1 con profili target distinti, che insieme costituiscono una classe di piccole molecole non sfruttata. Questi studi forniscono una base per lo sviluppo preclinico di questi agenti e indicano il potenziale più ampio di sfruttare l’attività SULT1A1 per strategie di target selettivo“.
“Sapevamo che i farmaci dipendenti da SULT1A1 erano già stati identificati“, ha detto Bardeesy. “I nostri risultati suggeriscono che potrebbero esserci altri composti dipendenti da SULT1A1 con gamme di bersagli diversi. L’identificazione di tali composti e bersagli sulle cellule potrebbe avere potenziali implicazioni per lo sviluppo di altri tipi di piccole molecole e farmaci, non solo limitati a questi tumori. Questo potrebbe diventare un nuovo approccio per alcune malattie“.
Fonte:Nature Cancer