I ricercatori della Queen Mary University di Londra hanno scoperto un nuovo meccanismo immunitario negli osteociti, il tipo più comune di cellule ossee, che potrebbe portare a nuovi farmaci per bloccare le metastasi ossee del cancro al seno e alla prostata.
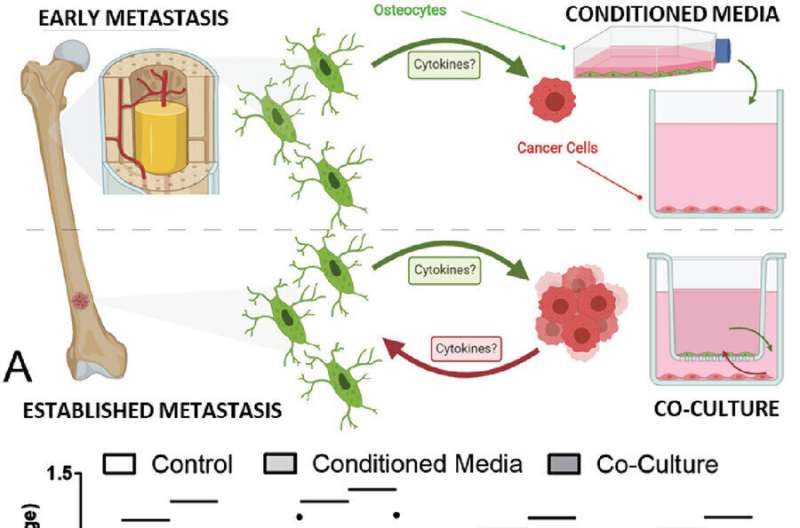
Astratto grafico: i terreni condizionati dagli osteociti hanno inibito la proliferazione e aumentato la migrazione delle cellule tumorali del seno e della prostata, con l’assenza di questo effetto nella co-coltura suggerendo l’esistenza di un meccanismo di feedback in vivo. Credito: Scienza avanzata.
Lo studio, pubblicato su Advanced Science, ha scoperto che gli osteociti possono utilizzare questo meccanismo per sopprimere la crescita delle cellule tumorali del seno e della prostata. Tuttavia, le cellule tumorali possono intervenire per impedire alle cellule ossee di sviluppare questa caratteristica, con conseguente promozione della crescita del tumore.
Sebbene i tassi di sopravvivenza nel cancro al seno e alla prostata, i due tumori più comuni, siano aumentati grazie ai miglioramenti nello screening e nel trattamento, questi pazienti presentano livelli elevati di dolore e minori possibilità di sopravvivenza se i tumori si diffondono (metastatizzano) nelle loro ossa, una progressione comune.
L’interazione tra cellule ossee e cellule tumorali è stata precedentemente poco compresa, quindi lo studio mirava a indagare su come i tumori al seno e alla prostata si diffondono e crescono all’interno delle ossa. Utilizzando la coltura cellulare e la tecnologia organ-on-a-chip, i ricercatori hanno identificato un nuovo meccanismo attraverso il quale le nostre cellule ossee vengono dirottate per consentire al tumore di crescere più velocemente.
Lo studio ha scoperto che gli osteociti, di gran lunga il tipo di cellula ossea più comune che costituisce oltre il 90% delle nostre cellule ossee, possiedono un meccanismo immunitario che possono utilizzare per sopprimere la crescita delle metastasi del seno o della prostata. Tuttavia, si crea un circolo vizioso di feedback quando le cellule tumorali intervengono per impedire “alle cellule ossee di sviluppare questa caratteristica e quindi bloccare questa soppressione, determinando invece una promozione della crescita del tumore”.
È probabile che questa inibizione iniziale delle cellule tumorali da parte degli osteociti possa in parte spiegare perché i tumori al seno e alla prostata spesso rimangono dormienti prima di stabilire colonie metastatiche nel tessuto osseo.
“La scoperta di questo nuovo meccanismo molecolare dimostra l’importanza delle cellule tumorali per la segnalazione degli osteociti nella regolazione delle metastasi ossee al seno e alla prostata, e supporta ulteriormente lo sviluppo di terapie che mirano e interrompono questo percorso”, spiegano i ricercatori.
In particolare, questi risultati rivelano due nuovi bersagli farmacologici specifici che potrebbero essere utilizzati per supportare la soppressione degli osteociti delle cellule tumorali da parte del TNF-α o per impedire alle cellule tumorali di bloccare questa soppressione tramite TGF-β.
Il Dottor Stefaan Verbruggen, docente di tecnologia medica presso la Facoltà di ingegneria e scienza dei materiali della Queen Mary University, afferma: “La cosa più importante e insolita è che, poiché questo meccanismo colpisce sia il cancro al seno che quello alla prostata, i tumori più comuni, il numero di pazienti che possono avere un beneficio è enorme“.
Il proseguimento del lavoro con il modello di chip d’organo con metastasi ossee consentirà al team di sviluppare un microambiente tumorale umano 3D più complesso e quindi di indagare e testare ulteriormente queste nuove terapie identificate.
Leggi anche:Cancro alla prostata: approccio terapeutico promettente per le metastasi ossee
Il lavoro faceva parte di una borsa di studio Marie Curie per Stefaan Verbruggen e di una collaborazione tra il Professor Martin Knight della Queen Mary University di Londra e il Professor Chris Jacobs della Columbia University, che purtroppo è morto di cancro prima che lo studio fosse completato. Il documento contiene una dedica alla sua memoria.
Immagine Credit Public Domain-
Fonte:Queen Mary University