(Antibiotici-Immagine Credit Public Domain).
Gli scienziati dell’EMBL aprono la strada alla riduzione degli effetti collaterali dannosi che gli antibiotici hanno sui batteri intestinali.
Gli antibiotici ci aiutano a curare le infezioni batteriche e a salvare milioni di vite ogni anno. Ma possono anche danneggiare i microbi utili che risiedono nel nostro intestino, indebolendo una delle prime linee di difesa del nostro corpo contro gli agenti patogeni e compromettendo i molteplici effetti benefici che il nostro microbiota ha per la nostra salute. Gli effetti collaterali comuni di questo danno collaterale degli antibiotici sono problemi gastrointestinali e infezioni ricorrenti da Clostridioides difficile . Includono anche problemi di salute a lungo termine, come lo sviluppo di malattie allergiche, metaboliche, immunologiche o infiammatorie.
I ricercatori del gruppo Typas presso EMBL Heidelberg, il laboratorio Maier presso il Cluster of Excellence “Controlling Microbes to Fight Infections” presso l’Università di Tubinga e collaboratori, hanno analizzato gli effetti di 144 antibiotici sui nostri microbi intestinali più comuni. Lo studio pubblicato sulla rivista Nature migliora sostanzialmente la nostra comprensione degli effetti degli antibiotici sui microbi intestinali. Suggerisce anche un nuovo approccio per mitigare gli effetti negativi della terapia antibiotica sul microbioma intestinale.
L’intestino umano ospita un’intricata comunità di diverse specie microbiche e molti virus, indicati collettivamente come microbioma intestinale. Insieme, ci consentono di utilizzare i nutrienti in modo più efficiente e impediscono ai batteri patogeni di stabilirsi nel nostro intestino. Tuttavia, quando trattiamo un’infezione batterica con antibiotici, c’è il rischio di danneggiare il microbioma intestinale.
“Molti antibiotici inibiscono la crescita di vari batteri patogeni. Questo ampio spettro di attività è utile nel trattamento delle infezioni, ma aumenta il rischio che anche i microbi nel nostro intestino vengano presi di mira”, ha spiegato Lisa Maier, capogruppo del DFG Emmy Noether presso l’Università di Tubinga. Maier è un ex allievo del laboratorio Typas e uno dei due autori principali dello studio.
Se alcuni batteri intestinali vengono danneggiati più di altri, la terapia antibiotica può portare a uno squilibrio nella composizione del nostro microbiota, comunemente indicato come disbiosi. La diarrea è un effetto comune a breve termine, mentre condizioni allergiche come l’asma o le allergie alimentari e l’obesità sono possibili conseguenze a lungo termine. Il fatto che gli antibiotici siano attivi anche contro i microbi intestinali è noto da molto tempo, ma i loro effetti sulla grande diversità di microbi che portiamo nel nostro intestino non erano ancora stati studiati sistematicamente, principalmente a causa di sfide tecniche.
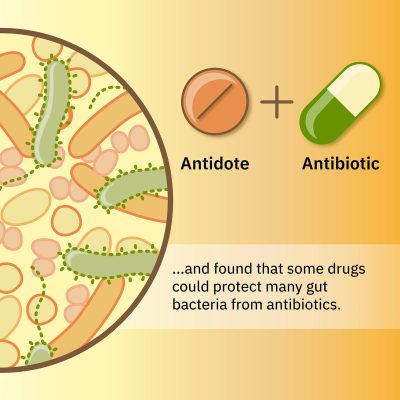
Gli antibiotici aiutano il nostro corpo a liberarsi delle infezioni batteriche. Ma possono anche danneggiare i microbi utili nel nostro intestino. Gli scienziati dell’EMBL hanno studiato i danni collaterali causati dagli antibiotici e hanno scoperto che alcuni farmaci potrebbero proteggere molti batteri intestinali dagli antibiotici. Credito: Isabel Romero Calvo/EMBL
“Finora, la nostra conoscenza degli effetti di diversi antibiotici sui singoli membri delle nostre comunità microbiche intestinali è stata irregolare. Il nostro studio colma le principali lacune nella nostra comprensione di quale tipo di antibiotico influisce su quali tipi di batteri e in che modo”, ha affermato Nassos Typas, scienziato senior e leader del gruppo presso EMBL Heidelberg.
Basandosi su uno studio precedente dei gruppi Typas, Bork, Patil e Zeller dell’EMBL, gli scienziati hanno osservato come ciascuno dei 144 antibiotici ha influenzato la crescita e la sopravvivenza di un massimo di 27 ceppi batterici che popolano comunemente le nostre viscere. I ricercatori hanno determinato le concentrazioni alle quali un dato antibiotico influenzerebbe questi ceppi batterici per oltre 800 combinazioni di antibiotici-ceppi, ampliando del 75% i set di dati esistenti sugli spettri di antibiotici nelle specie batteriche intestinali.
È importante sottolineare che gli esperimenti hanno rivelato che tetracicline e macrolidi, due famiglie di antibiotici comunemente usati, non solo hanno impedito ai batteri di crescere, ma ne hanno anche causato la morte. Circa la metà dei ceppi intestinali testati non è sopravvissuta al trattamento con questi tipi di antibiotici.
“Non ci aspettavamo di vedere questo effetto con tetracicline e macrolidi, poiché si riteneva che queste classi di antibiotici avessero solo effetti batteriostatici, il che significa che bloccano la crescita batterica, ma non uccidono i batteri”, ha affermato Camille Goemans, un borsista post-dottorato nel gruppo Typas che condivide la prima paternità dello studio con Maier. “I nostri esperimenti mostrano che questa ipotesi non è vera per circa la metà dei microbi intestinali che abbiamo studiato. La Doxiciclina, l’Eritromicina e l’Azitromicina, tre antibiotici comunemente usati, hanno ucciso diverse specie microbiche intestinali abbondanti, mentre altre le hanno semplicemente inibito.
Vedi anche:Cancro del colon: trovato legame con antibiotici
L’uccisione selettiva di microbi specifici da parte di tetracicline e macrolidi potrebbe portare alla perdita involontaria di questi microbi dal microbiota intestinale molto più velocemente dei microbi per i quali la crescita è solo inibita, come hanno dimostrato gli autori con le comunità microbiche sintetiche. Ciò potrebbe spiegare i forti cambiamenti del microbiota di cui sono testimoni alcuni pazienti in trattamento con questi antibiotici.
C’è un modo per ridurre i danni, però. “Abbiamo già dimostrato che i farmaci interagiscono in modo diverso tra le diverse specie batteriche. Abbiamo quindi esplorato se un secondo farmaco potrebbe mascherare gli effetti dannosi degli antibiotici su abbondanti microbi intestinali, ma consentire agli antibiotici di mantenere la loro attività contro i patogeni. Ciò fornirebbe qualcosa come un antidoto, che ridurrebbe il danno collaterale degli antibiotici sui batteri intestinali“, ha spiegato Typas.
Gli scienziati hanno combinato gli antibiotici Eritromicina o Doxiciclina con una serie di quasi 1.200 farmaci, per identificare i farmaci che salverebbero dall’antibiotico due abbondanti specie batteriche intestinali. In effetti, i ricercatori hanno identificato diversi farmaci non antibiotici che potrebbero salvare questi microbi intestinali e altre specie correlate. È importante sottolineare che la combinazione di un antibiotico con un secondo farmaco protettivo non ha compromesso l’efficacia degli antibiotici contro i batteri patogeni.
Gli esperimenti di follow-up hanno indicato che questo approccio potrebbe funzionare anche nel contesto di un microbioma naturale. Con l’aiuto dei collaboratori, gli scienziati hanno dimostrato che la combinazione di Eritromicina con un antidoto ha mitigato la perdita di alcune abbondanti specie batteriche intestinali dall’intestino del topo. Allo stesso modo, i farmaci antidoto proteggevano i microbi intestinali umani dall’Eritromicina in complesse comunità batteriche derivate da campioni di feci.
“Il nostro approccio che combina gli antibiotici con un antidoto protettivo potrebbe aprire nuove opportunità per ridurre gli effetti collaterali dannosi degli antibiotici sui nostri microbiomi intestinali”, ha concluso Maier. “Nessun singolo antidoto sarà in grado di proteggere tutti i batteri nel nostro intestino, soprattutto perché questi differiscono così tanto tra gli individui. Ma questo concetto apre le porte allo sviluppo di nuove strategie personalizzate per mantenere sani i nostri microbi intestinali”.
Saranno necessarie ulteriori ricerche per identificare le combinazioni, il dosaggio e le formulazioni ottimali per gli antidoti e per escludere potenziali effetti a lungo termine sul microbioma intestinale. In futuro, il nuovo approccio potrebbe aiutare a mantenere sano il nostro microbioma intestinale e ridurre gli effetti collaterali degli antibiotici nei pazienti, senza compromettere l’efficienza dei nostri antibiotici salvavita.
Fonte:Nature