(Anemia falciforme-Immagine Credit Public Domain).
“Una terapia genica che potrebbe fornire una cura permanente per l’anemia falciforme continua a mostrare successo attraverso l’applicazione su una terza ondata di pazienti”, riferiscono i ricercatori.
La terapia, LentiGlobin, ha ripristinato la normale funzione sanguigna in 35 pazienti con anemia falciforme che hanno ricevuto la procedura una tantum, secondo i risultati degli studi clinici pubblicati il 12 dicembre sul New England Journal of Medicine (NEJM).
“Tutti i pazienti ora producono quantità stabili di globuli rossi normali, cellule che contengono l’emoglobina sana”, ha detto il ricercatore Dr. Julie Kanter, Direttore della University of Alabama e Sickle Cell di Birmingham Clinic. “Inoltre, non hanno subito i gravi episodi di dolore che accompagnano l’anemia falciforme”, ha aggiunto.
“È l’inizio di una nuova vita” per questi pazienti“, ha detto Kanter.
Finora circa 49 pazienti sono stati trattati con LentiGlobin, secondo lo sviluppatore della terapia genica, la società farmaceutica Bluebird Bio.
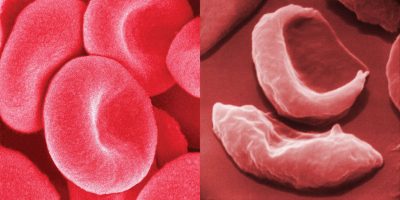
L‘anemia falciforme colpisce la forma dei globuli rossi di una persona. Normalmente, queste cellule sono a forma di disco e abbastanza flessibili da muoversi facilmente attraverso i vasi sanguigni. I globuli rossi di una persona con anemia falciforme sono a forma di mezzaluna, simili a una falce. Le cellule sono rigide e appiccicose e causano episodi di dolore e altri problemi di salute quando si raggruppano in diverse parti del corpo.
“Questi problemi sono causati da una sostanza chiamata emoglobina, che è la parte di un globulo rosso che trasporta l’ossigeno ai tessuti di tutto il corpo”, ha spiegato Kanter. “Un gene difettoso induce il corpo a produrre emoglobina difettosa che distorce la forma delle cellule del sangue. Queste cellule trasportano ancora ossigeno, ma non lo trattengono e quando lo rilasciano, l’emoglobina si intreccia con le altre emoglobine, causando la deformazione della cellula e la forma di falce”.
In questa terapia, le cellule staminali vengono rimosse dal midollo osseo che produce sangue di una persona. I tecnici di laboratorio le espongono a un virus che inserisce in esse una copia sana del gene difettoso dell’emoglobina. Mentre questo avviene, il midollo osseo rimanente del paziente viene ucciso con la chemioterapia. Le cellule staminali riparate in laboratorio vengono quindi impiantate e iniziano a produrre emoglobina sana.
“Questo è un po’ come fare un trapianto di midollo osseo in te stesso”, ha detto il Dottor Lewis Hsu, Direttore medico della Sickle Cell Disease Association of America.
L’aggiornamento dello studio clinico pubblicato sul NEJM – e presentato contemporaneamente a una riunione dell’American Society of Hematology, ad Atlanta – affermava che, dopo tre anni dal loro trattamento, la terza ondata di pazienti con trattati cone LentiGlobin mostrava una serie di segni promettenti che indicavano un cura permanente:
- Quasi tutti i loro globuli rossi contengono emoglobina sana, piuttosto che l’emoglobina difettosa causata da geni difettosi.
- I loro globuli rossi si stanno degradando a un ritmo normale; l’anemia falciforme di solito fa sì che le cellule si rompano molto più velocemente.
- Nessuno aveva avuto episodi di dolore severo che li avevano portati al pronto soccorso; prima del trattamento, in genere soffrivano di più di tre episodi di dolore all’anno.
“Questo è un enorme miglioramento, poiché molti di questi individui hanno avuto più eventi prima di questo trapianto in Ospedale o nel Pronto Soccorso a causa di questi orribili eventi dolorosi”, ha detto Kanter.
I ricercatori continuano a monitorare i pazienti per un’indicazione finale di una vera cura: la salute a lungo termine dei loro organi. La cellula falciforme mette sotto stress i reni, i polmoni, il cuore e il cervello e si spera che il trattamento con LentiGlobin prevenga i danni agli organi causati dalla malattia.
Hsu ha precisato che ci sono problemi di sicurezza che devono ancora essere risolti con la procedura. “Uno dei primi pazienti trattati con LentiGlobin ha sviluppato la leucemia circa cinque anni dopo ed è morto”, ha detto Hsu. Un secondo articolo pubblicato sul nuovo NEJM ha fatto luce sulla sua morte, spiegando che il LentiGlobin stesso non ha causato direttamente la leucemia al paziente morto. Invece, sembra essere stata causata in qualche modo dalla sua anemia falciforme in combinazione con la procedura di trapianto. “La leucemia è una preoccupazione per questa terapia”, ha detto Kanter. “Ci preoccupiamo che quando il virus inserisce il nuovo gene, lo inserisca da qualche parte in cui non dovrebbe”.
Vedi anche:Anemia falciforme: terapia genica interrota per complicazioni
Spiegano gli autori:
“L’anemia falciforme è caratterizzata dalla recidiva dolorosa di eventi vaso-occlusivi. La terapia genica con l’uso di LentiGlobin per l’anemia falciforme (bb1111; lovotibeglogene autotemcel) consiste nel trapianto autologo di cellule staminali e progenitrici ematopoietiche trasdotte con il vettore lentivirale BB305 che codifica un gene β-globina modificato, che produce un’emoglobina antifalcetica, HbA T87Q. In questo studio di fase 1-2 in corso, abbiamo ottimizzato il processo di trattamento nei primi 7 pazienti del gruppo A e 2 pazienti del gruppo B con anemia falciforme. Il gruppo C è stato istituito per la valutazione cardine di LentiGlobin per l’anemia falciforme e abbiamo adottato un criterio di inclusione più rigoroso che richiedeva un minimo di quattro eventi vaso-occlusivi gravi nei 24 mesi prima dell’arruolamento. In questa analisi ad interim non specificata, abbiamo valutato la sicurezza e l’efficacia di LentiGlobin in 35 pazienti arruolati nel Gruppo C. Incluso in questa analisi era il numero di gravi eventi vaso-occlusivi dopo l’infusione di LentiGlobin tra i pazienti con almeno quattro eventi vaso-occlusivi nel 24 mesi prima dell’iscrizione e con almeno 6 mesi di follow-up. CONCLUSIONI:il trattamento una tantum con LentiGlobin ha determinato una produzione sostenuta di HbA T87Q nella maggior parte dei globuli rossi, portando a una ridotta emolisi e alla completa risoluzione di gravi eventi vaso-occlusivi”.
“Da quella prima ondata di pazienti”, ha affermato Kanter, “i ricercatori hanno cambiato il modo in cui vengono raccolte le cellule staminali e il modo in cui viene loro introdotto il virus”. I ricercatori sperano che i cambiamenti prevengano il processo che ha causato la leucemia. “Speriamo di aver evitato quello stress extra sul midollo osseo”, ha detto Kanter. Insieme, i due documenti stanno “mostrando risultati davvero buoni”. Hsu ha detto che la cosa importante ora è capire quali rischi può comportare la terapia genica.
Kanter prevede che LentiGlobin passerà all’approvazione della Food and Drug Administration statunitense entro i prossimi due anni. La cura probabilmente sarà costosa, tenendo conto del costo della terapia, della chemioterapia e delle settimane trascorse in Ospedale.
“Sfortunatamente, penso che per molto tempo queta cura sarà molto costosa. I prossimi passi sono come renderla più facile, meno costosoìa e più disponibile”, ha detto Kanter.