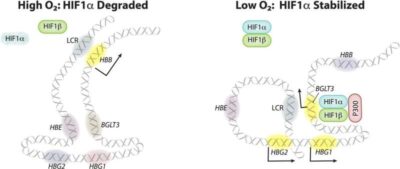
(Anemia falciforme-Immagine:M mdello dell’attivazione della trascrizione della γ-globina da parte di HIF1α in cellule eritroidi di tipo adulto. Credito:Nature via Medicalxpress).
“L’anemia falciforme è una malformazione genetica ereditaria dell’emoglobina (la proteina che trasporta l’ossigeno contenuto nei globuli rossi) caratterizzata dalla presenza di globuli rossi a forma di falce (mezzaluna) e da anemia cronica dovuta all’eccessiva distruzione dei globuli rossi anomali”.
Gli scienziati del St. Jude Children’s Research Hospital hanno dimostrato come una proteina responsabile dell’adattamento a condizioni di basso livello di ossigeno (ipossia), provochi una maggiore espressione dell’emoglobina fetale (HbF) negli adulti. La scoperta ha implicazioni per il trattamento dell’anemia falciforme e della beta-talassemia, gravi malattie del sangue che colpiscono milioni di individui.
La ricerca è stata pubblicata oggi su Nature.
L’emoglobina è come una spugna proteica che assorbe l’ossigeno e consente ai globuli rossi di traghettarlo in tutto il corpo. L’emoglobina adulta contiene quattro subunità proteiche: due beta-globina e due alfa-globina.
Le mutazioni nella beta-globina causano anemia falciforme e beta-talassemia. Ma gli esseri umani hanno un altro gene della subunità dell’emoglobina (gamma-globina), che viene espresso al posto della beta-globina durante lo sviluppo fetale. La gamma-globina si combina con l’alfa-globina per formare HbF. Normalmente intorno alla nascita, l’espressione della gamma-globina viene disattivata e la beta-globina viene attivata, determinando il passaggio dall’HbF all’emoglobina adulta.
“Sappiamo da molti anni che l’espressione persistente di HbF dopo la nascita può alleviare i sintomi dell’anemia falciforme e della beta-talassemia“, ha affermato l’autore corrispondente Mitchell J. Weiss, MD, Ph.D., Presidente del dipartimento di ematologia di St. Jude. “E livelli di HbF molto elevati possono curare queste malattie, nonostante la presenza dei geni difettosi della beta-globina. Pertanto, molti laboratori si concentrano sulla comprensione del passaggio perinatale dall’espressione genica della gamma alla beta-globina e sulla ricerca di nuovi modi per invertire questo passaggio con farmaci o terapie genetiche”.
Ripristino della produzione di HbF negli adulti
Il gruppo di St. Jude ha scoperto che il fattore 1 inducibile dall’ipossia (HIF1) promuove direttamente la trascrizione del gene della gamma-globina per migliorare la produzione di HbF. HIF1 è un componente importante della capacità delle cellule di percepire e adattarsi alle condizioni ipossiche. In condizioni di basso livello di ossigeno, HIF1 si accumula in molti tessuti e attiva centinaia di geni, incluso l’HbF nei globuli rossi.
Vedi anche:Anemia falciforme e betalassemia: passo avanti della ricerca
Il primo autore dello studio, Ruopeng Feng, Ph.D., scienziato del laboratorio Weiss, ha dimostrato che un farmaco che attiva parte della risposta all’ipossia cellulare inibisce l’anemia falciforme. Il farmaco, un inibitore della prolina idrossilasi, ha fatto accumulare HIF1, lega una regione regolatrice del DNA vicino al gene della gamma globina, attivando la sua trascrizione per produrre HbF e inibire la formazione di globuli rossi a forma di “falce”.
Gli inibitori della prolina idrossilasi sono attualmente in fase di sviluppo clinico avanzato per il trattamento dell’anemia associata a malattia renale cronica. Questi farmaci agiscono stabilizzando le proteine HIF per stimolare la produzione di eritropoietina, un ormone che guida la produzione di globuli rossi.
“I nostri risultati indicano che gli inibitori della prolina idrossilasi potrebbero essere utili per il trattamento dell’anemia falciforme o della beta-talassemia, dove l’attivazione della produzione di HbF, ha benefici terapeutici“, ha detto Weiss. “Circa il 20% dei pazienti adulti con anemia falciforme sviluppa insufficienza renale con anemia correlata. Gli inibitori della prolina idrossilasi potrebbero avere un duplice scopo in questi individui, stimolando la produzione sia di eritropoietina che di HbF”.
Legare la risposta dell’ipossia all’HbF
Il Premio Nobel per la Fisiologia o la Medicina è stato assegnato alla scoperta del percorso HIF nel 2019. L’attuale studio, guidato dal gruppo di Weiss, stabilisce una connessione diretta tra questo adattamento dell’ipossia e l’espressione di HbF. Questa connessione spiega osservazioni cliniche di lunga data secondo cui l’HbF è indotta durante la produzione accelerata di globuli rossi dopo l’esposizione all’ipossia o in alcune forme di anemia, condizioni chiamate “eritropoiesi da stress”.
“L’identificazione della gamma-globina come gene bersaglio HIF supporta l’idea che l’HbF si sia evoluto come meccanismo protettivo contro l’ipossia“, ha detto Weiss.
Fonte:Nature / Medicalxpress