(Anemia falciforme-Immagine Credit Public Domain).
Nel 2014, due anni dopo la sua invenzione dell’editing del genoma CRISPR-Cas9 vincitrice del Premio Nobel, Jennifer Doudna pensava che la tecnologia fosse abbastanza matura per affrontare una cura per una devastante malattia ereditaria, l’anemia falciforme, che affligge milioni di persone in tutto il mondo, la maggior parte di loro di origine africana. Circa 100.000 persone di colore negli Stati Uniti sono affette dalla malattia.
Mobilitando i colleghi dell’allora nuovo Innovative Genome Institute (IGI) – una collaborazione di ricerca congiunta tra l’Università della California, Berkeley e UC San Francisco – hanno cercato di riparare la singola mutazione che fa deformare e ostruire le arterie dei globuli rossi, causando lancinante dolore e spesso morte. I trattamenti disponibili oggi in genere comportano trasfusioni regolari, sebbene i trapianti di midollo osseo possano curare coloro che riescono a trovare un donatore compatibile.
Dopo sei anni di lavoro, quel trattamento sperimentale è stato ora approvato per gli studi clinici dalla Food and Drug Administration statunitense, consentendo i primi test sull’uomo di una terapia a base di CRISPR/Cas9 per correggere direttamente la mutazione nel gene della beta-globina responsabile della anemia falciforme. La beta-globina è una delle proteine del complesso emoglobinico responsabile del trasporto dell’ossigeno in tutto il corpo.
Gli studi, che dovrebbero durare quattro anni, saranno guidati dai medici dell’UCSF Benioff Children’s Hospital di Oakland e del Broad Stem Cell Research Center dell’UCLA che intendono iniziare questa estate per arruolare sei adulti e tre adolescenti con grave anemia falciforme.

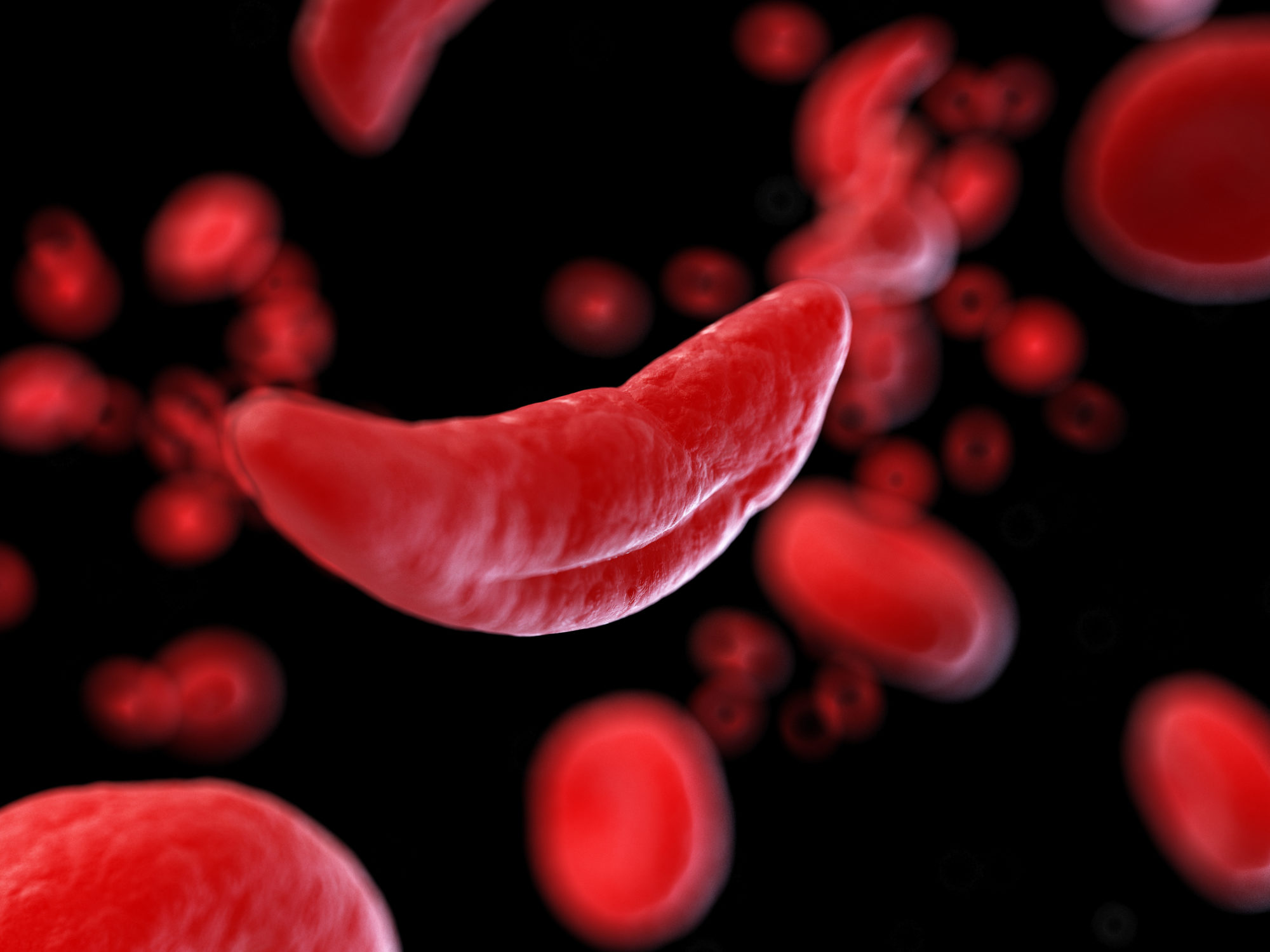
L’anemia falciforme è causata da una mutazione nel gene della beta-globina che fa deformare i globuli rossi in una forma a falce (in primo piano) rispetto alla normale forma circolare vista sullo sfondo. Le cellule falciformi ostruiscono le arterie, causando dolore intenso e danni agli organi. Credito immagine: Innovative Genomics Institute, UC Berkeley
Il laboratorio di diagnostica clinica dell’IGI, che è stato costruito sotto la guida di Doudna per fornire test COVID-19 gratuiti alla comunità di Berkeley, svolgerà un ruolo chiave nel supporto analitico per lo studio sviluppando la diagnostica per monitorare il benessere del paziente e monitorare l’efficienza del trattamento. “Siamo motivati a lavorare per una cura che possa essere accessibile e conveniente per i pazienti di tutto il mondo”, ha affermato Doudna, Professore di biologia molecolare e cellulare e di chimica all’Università di Berkeley e ricercatore dell’Howard Hughes Medical Institute. “Il lancio di questa sperimentazione è un primo passo essenziale in questo percorso”.
Altri studi hanno utilizzato con successo CRISPR-Cas9 per eliminare un gene che sopprime il gene dell’emoglobina fetale, che normalmente è disattivato negli esseri umani. Questa tecnica risveglia il gene fetale e, in almeno tre pazienti, ha alleviato i sintomi dell’anemia falciforme. Il nuovo studio invece, propone un gene knock-in: i ricercatori stanno usando CRISPR-Cas9 per sostituire il gene della beta-globina difettoso con una versione riparata, con l’obiettivo di creare globuli rossi normali e adulti e curare il disturbo.
“Questa terapia ha il potenziale per trasformare la cura dell’anemia falciforme producendo un trattamento curativo accessibile che è più sicuro dell’attuale terapia del trapianto di cellule staminali da un donatore di midollo osseo”, ha affermato il Dott. Mark Walters, Professore di pediatria presso l’UCSF e ricercatore principale della sperimentazione clinica e del progetto di editing genetico. “Se questo trattamento viene applicato con successo nei pazienti giovani, ha il potenziale per prevenire le complicanze irreversibili della malattia”.
La tecnica, come con l’approccio alternativo che risveglia l’emoglobina fetale, richiede che alcune delle cellule staminali ematopoietiche del paziente – le cellule del midollo osseo che generano tutti i globuli rossi del corpo – siano raccolte per l’editing genetico al di fuori del corpo. Dopo che queste cellule sono state rimosse, il midollo osseo rimanente viene distrutto con la chemioterapia per lasciare spazio alla crescita delle cellule staminali riparate e reinfuse.
Walters, che è anche il Direttore del programma di trapianti di sangue e midollo presso l’UCSF Benioff Children’s Hospital di Oakland, lavorerà con il medico-scienziato dell’UCLA Dr. Donald Kohn che ha sviluppato terapie geniche per diverse malattie genetiche del sangue, inclusa una cura per una forma di immunodeficienza combinata grave (SCID). Kohn sta anche conducendo una sperimentazione clinica di un diverso tipo di terapia genica per l’anemia falciforme che prevede l’aggiunta di un nuovo gene alle cellule staminali dei pazienti per superare la mutazione delle cellule falciformi.
“La terapia genica e l’editing genetico consentono a ciascun paziente di fungere da donatore di cellule staminali”, ha affermato Kohn, un illustre Professore di microbiologia, immunologia e genetica molecolare, pediatria e farmacologia molecolare e medica presso la David Geffen School of Medicine dell’UCLA e un membro dell’UCLA Broad Stem Cell Research Center. “In teoria, questi approcci dovrebbero essere molto più sicuri di un trapianto da un’altra persona e potrebbero diventare universalmente disponibili perché eliminano la necessità di trovare l’ago in un pagliaio che è un donatore di cellule staminali compatibile”.
Kohn guiderà le attività di laboratorio e di sperimentazione clinica presso la UCLA e supervisionerà tutta la produzione del prodotto farmaceutico, chiamato CRISPR_SCD001, per la sperimentazione clinica. Il lavoro preclinico per sviluppare questa terapia è stato finanziato dal California Institute for Regenerative Medicine; Cure Sickle Cell Initiative, guidata dal National Heart, Lung, and Blood Institute e Fondazione di beneficenza Doris Duke.
Fyodor Urnov, Direttore della tecnologia e della traduzione dell’IGI e Professore di biologia molecolare e cellulare all’Università di Berkeley, supervisionerà le attività di bioinformatica e genomica per lo studio. “È degno di nota il fatto che questo nuovo studio provenga da un consorzio di istituzioni accademiche senza scopo di lucro incentivate con una visione a lungo termine per curare la malattia con una soluzione economica che possa beneficiare a livello globale di tutti coloro che ne hanno bisogno”, ha affermato Urnov.
L’anemia falciforme è causata da un singolo cambiamento nel codice del DNA del gene della beta-globina. Il nuovo studio utilizza la nucleasi CRISPR-Cas9 – una proteina Cas9 completamente assemblata e una sequenza di RNA guida che mira alla regione difettosa del gene della beta-globina, accompagnata da un breve segmento di DNA che codifica la sequenza corretta – per stimolare la riparazione della mutazione nell’anemia falciforme, sostituendo il segmento di DNA normale con quello anormale. In questo approccio, le cellule staminali del sangue del paziente vengono prima trattate con impulsi elettrici che creano pori nelle loro membrane. Questi pori consentono alla piattaforma CRISPR-Cas9 di entrare nelle cellule staminali e viaggiare verso i loro nuclei per correggere la mutazione delle cellule falciformi.
Vedi anche:Anemia falciforme: editing di base nuovo trattamento
“L’obiettivo di questa forma di terapia di modifica del genoma è correggere la mutazione in un numero sufficiente di cellule staminali in modo che il sangue risultante in circolazione abbia corretto i globuli rossi”, ha affermato Walters. “Sulla base della nostra esperienza con i trapianti di midollo osseo, prevediamo che la correzione del 20% dei geni dovrebbe essere sufficiente per competere con le cellule falciformi native e avere un forte beneficio clinico”.
Il protocollo di produzione finale utilizza un metodo privo di virus per modificare le cellule staminali del sangue ed è stato convalidato in studi preclinici di sicurezza/tossicologia eseguiti previa consultazione con la FDA.
Terapie CRISPR future per anemia falciforme e altre malattie del sangue
Mentre i medici della UC portano l’attuale terapia CRISPR negli studi clinici, gli scienziati dell’IGI stanno lavorando per migliorare la tecnica in modo che, alla fine, la correzione della mutazione della cellula falciforme possa essere eseguita all’interno del corpo, senza rimuovere le cellule staminali o distruggere il midollo osseo. Poiché il midollo osseo produce anche globuli bianchi che ci proteggono dalle malattie, distruggendolo si smorza il sistema immunitario ed espone i pazienti a un rischio maggiore di infezione o addirittura di cancro fino a quando le cellule staminali corrette e infuse non possono moltiplicarsi e ricostituirsi.

Rappresentazione grafica di CRISPR-Cas9 che ripara la mutazione nel gene che causa l’anemia falciforme (mostrato in azzurro). Credito immagine: Innovative Genomics Institute
“Attualmente, stiamo effettuando una terapia ex vivo, in cui si preleviamo cellule dal midollo osseo per correggere la mutazione al di fuori del corpo”, ha affermato Ross Wilson, Direttore della somministrazione terapeutica dell’IGI. “Ma durante questo periodo – potrebbero essere necessari dei mesi – il midollo osseo si sta riempiendo di nuovo. Di conseguenza, quando è il momento di infondere le cellule corrette, il paziente deve essere sottoposto a chemioterapia aggressiva che ripulisce il midollo osseo e consente a quelle cellule corrette di trovare una casa”.
Wilson è ottimista sul fatto che lui e gli scienziati dell’IGI possano trovare un modo per inviare la terapia CRISPR direttamente al midollo osseo all’interno del corpo, utilizzando anticorpi per indirizzare l’enzima CRISPR alle cellule staminali corrette. Altri scienziati, che utilizzano virus ingegnerizzati o goccioline di grasso – nanoparticelle lipidiche – per trasportare l’enzima CRISPR nel corpo, finora hanno fallito.
“La molecola che stiamo cercando di fornire è fisicamente più piccola – un ottavo del diametro delle nanoparticelle che altre persone cercano di fornire al midollo osseo – e questo potrebbe fornire grandi benefici”, ha affermato. “Il nostro enzima che si autoalimenta dovrebbe essere in grado di raggiungere il midollo osseo”.
Qualunque sia la strategia di successo, ex vivo o in vivo, la piattaforma CRISPR sviluppata per l’anemia falciforme potrebbe trasformare la terapia genica per altre malattie.
“Questa è la visione dell’IGI: prima la cellula falciforme, ma i nostri sforzi avranno un effetto a catena per consentire cure per i disturbi del sangue in generale, come la beta-talassemia, così come le malattie del sistema immunitario”, ha affermato. “La cellula staminale ematopoietica è il seme per l’intero sistema immunitario, quindi tutti i disturbi del sangue possono teoricamente essere curati con una terapia con cellule staminali come questa”.
Fonte: UC Berkeley