Un nuovo studio rivela che nella malattia di Alzheimer, un frammento della proteina precursore dell’amiloide (APP-CTF) interrompe i processi cellulari chiave, causando potenzialmente la morte precoce dei neuroni. Questa scoperta suggerisce che i trattamenti per l’AD dovrebb
Gli APP-CTF interferiscono con la comunicazione tra organelli, interrompendo l’equilibrio cellulare
La malattia di Alzheimer (AD) continua a essere una condizione neurodegenerativa significativa e diffusa, che colpisce milioni di persone in tutto il mondo. In uno studio recentemente pubblicato su Developmental Cell, i ricercatori del laboratorio di Wim Annaert (VIB-KU Leuven) hanno identificato un nuovo meccanismo potenzialmente collegato alle prime fasi dell’AD.
Hanno dimostrato che un frammento della proteina precursore dell’amiloide (APP), chiamato APP-CTF, interrompe la comunicazione tra i compartimenti cellulari cruciali per l’immagazzinamento del calcio e lo smaltimento dei rifiuti, il che potrebbe essere un evento precoce che precede la morte delle cellule neuronali. Questi risultati, con potenziali implicazioni per lo sviluppo di nuovi trattamenti per l’AD, suggeriscono che è necessario prendere in considerazione la prevenzione dell’accumulo di APP-CTF per sviluppare trattamenti più efficaci.
La malattia di Alzheimer è caratterizzata dalla progressiva perdita delle funzioni cognitive, deterioramento della memoria e cambiamenti comportamentali. Una delle caratteristiche visibili nel cervello delle persone con malattia di Alzheimer è la formazione di placche amiloidi – grumi di peptidi β-amiloide (Aβ), che sono prodotti degradati della proteina precursore dell’amiloide (APP). Questi frammenti Aβ si accumulano nei neuroni nelle prime fasi della malattia, anche prima che si osservi il declino cognitivo.
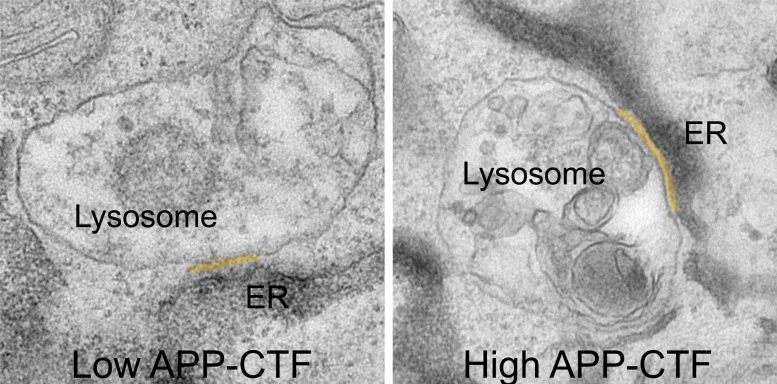
I frammenti APP-C-terminali (APP-CTF) si accumulano tra il reticolo endoplasmatico e i lisosomi. Credito: VIB
Una nuova ricerca, tuttavia, suggerisce che potrebbero verificarsi anche eventi precedenti nel cervello dell’AD prima della formazione delle placche e che la proteina APP svolge un ruolo in queste fasi iniziali. Il meccanismo alla base di ciò è rimasto fino ad ora un mistero.
Nel loro ultimo studio, il laboratorio di Wim Annaert presso il VIB-KU Leuven Center for Brain & Disease Research ha identificato un meccanismo che spiega come l’APP può contribuire a queste prime fasi dell’AD. Questa scoperta potrebbe portare a una nuova direzione nella ricerca e negli approcci terapeutici sull’AD.
Interruzione della comunicazione cellulare
L’APP si trova nelle membrane cellulari delle cellule cerebrali. Il cervello produce costantemente nuove molecole di APP mentre scompone e rimuove quelle vecchie. Questo processo coinvolge le forbici enzimatiche, con la gamma-secretasi che è quella finale che genera i peptidi Aβ ben noti e ben studiati nell’AD.
Per molto tempo si è pensato che il blocco della gamma-secretasi fosse il passo logico per prevenire la produzione di frammenti Aβ tossici. Tuttavia, ciò porta all’accumulo del loro precursore, i frammenti APP-C-Terminal o APP-CTF. Ora i ricercatori hanno scoperto che questi frammenti sono tossici anche per i neuroni. Sembra che si accumulino tra il reticolo endoplasmatico (ER), il compartimento cruciale per la sintesi dei lipidi e l’immagazzinamento del calcio e i lisosomi, i cosiddetti “contenitori dei rifiuti” dei neuroni, che sono fondamentali per degradare i prodotti di scarto della cellula.
“In questo modo, gli APP-CTF interrompono il delicato equilibrio del calcio all’interno dei lisosomi”, spiega la Dr.ssa Marine Bretou, prima autrice dello studio. “Questa interruzione innesca una cascata di eventi. L’ER non può più riempire efficacemente i lisosomi di calcio, portando ad un accumulo di colesterolo e ad un declino della loro capacità di scomporre i rifiuti cellulari. Ciò si traduce nel collasso dell’intero sistema endolisosomiale, un percorso cruciale per il mantenimento di neuroni sani”.
Il nuovo studio supporta inoltre che gli APP-CTF risultanti dalla soppressione della gamma-secretasi potrebbero effettivamente essere il colpevole della disfunzione endolisosomiale, come osservato nelle primissime fasi dell’AD.
Un cambio di paradigma nella comprensione delle prime fasi della patogenesi dell’AD
Questa ricerca fa avanzare significativamente la nostra comprensione delle potenziali cause della malattia nelle prime fasi dell’AD. Un risultato notevole di questo studio è che questi stadi iniziali potrebbero essere causati da un altro frammento della stessa molecola APP anziché da Aβ. Ciò ha implicazioni significative per gli attuali approcci terapeutici che mirano a eliminare le placche amiloidi dal cervello affetto da AD, poiché tendono a ignorare gli effetti tossici di altri frammenti. Altri tentativi si concentrano sulle proteine tau o sulla neuroinfiammazione, che sono altri segni distintivi della progressione dell’AD che prendono di mira eventi successivi. Tuttavia, un intervento precoce è probabilmente la chiave per fermare o addirittura prevenire l’AD.
Leggi anche:Debole rimozione dei rifiuti nel cervello collegata all Alzheimer
“Il fallimento degli studi clinici che utilizzano gli inibitori della gamma-secretasi può essere spiegato dal fatto che ci stavamo concentrando su un solo colpevole e in una fase troppo avanzata della malattia”, spiega il Prof. Wim Annaert, autore principale dello studio. “I risultati della nostra ricerca suggeriscono che i modulatori della gamma-secretasi, che possono aiutare a promuovere l’eliminazione degli APP-CTF tossici senza bloccare completamente l’enzima, potrebbero essere un obiettivo più rilevante per l’intervento precoce nell’AD. La chiave potrebbe essere trovare il giusto equilibrio tra l’eliminazione dell’APP-CTF e la prevenzione della placca”.
Spiegano gli autori:
“Le anomalie neuronali endosomiali e lisosomiali sono tra i primi cambiamenti osservati nella malattia di Alzheimer (AD) prima della comparsa delle placche. Tuttavia, non è chiaro se i difetti endolisosomiali distinti siano organizzati temporalmente e in che modo la funzione alterata della γ-secretasi o il metabolismo della proteina precursore dell’amiloide (APP) contribuiscano a questi cambiamenti. L’inibizione cronica della γ-secretasi, nei fibroblasti embrionali di topo e nei neuroni dell’ippocampo, ha portato ad un graduale collasso endolisosomiale avviato dalla diminuzione del calcio lisosomiale e dall’aumento del colesterolo, causando difetti a valle nel riciclaggio e nella maturazione endosomiale. Questa morte endolisosomiale dipende dalla γ-secretasi, richiede domini citoplasmatici APP legati alla membrana e viene salvata dalla deplezione di APP. Frammenti C-terminali (CTF) dell’APP localizzati nei contatti tardivi endosoma/lisosoma-reticolo endoplasmatico; un eccesso di APP-CTF in questo caso ha ridotto il rifornimento di Ca 2+ lisosomiale dal reticolo endoplasmatico, promuovendo l’accrescimento di colesterolo. La regolazione tonica da parte degli APP-CTF fornisce una spiegazione meccanicistica per la loro tossicità cellulare: l’incapacità di degradare tempestivamente gli APP-CTF sostiene la segnalazione a valle, istigando la disomeostasi lisosomiale, come osservato nell’AD prodromico. Questo è l’opposto di substrati come Notch, che richiedono la proteolisi intramembrana per avviare la segnalazione”.
astratto grafico

Immagine Credit Development Cell.
Guardando al futuro, gli scienziati stanno unendo gli sforzi con i colleghi per sviluppare questi modulatori sulla base di queste nuove intuizioni e continueranno a esplorare l’omeostasi cellulare nelle prime fasi dell’AD.
Fonte:Developmental Cell

