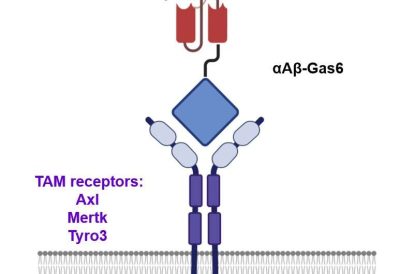
(Alzheimer-Immagine: schema di una proteina di fusione chimerica Gas6. Un singolo frammento variabile a catena (scFv) di un anticorpo monoclonale mirato all’amiloide β (Aβ) viene fuso con un dominio di legame del recettore troncato di Gas6, una molecola ponte per la clearance delle cellule morte tramite i recettori TAM (TYRO3, AXL e MERTK) , che sono espressi da microglia e astrociti. Credito: Gliabiology Lab & Kim Lab of Immunotherapy).
Sebbene Aduhelm, un anticorpo monoclonale mirato all’amiloide-beta (Aβ), sia recentemente diventato il primo farmaco approvato dalla FDA statunitense per il morbo di Alzheimer (AD) in base alla sua capacità di ridurre il carico di placca Aβ nei pazienti con AD, il suo effetto sul miglioramento cognitivo è ancora controverso.
Inoltre, circa il 40% dei pazienti trattati con questo anticorpo ha manifestato gravi effetti collaterali tra cui edemi cerebrali (ARIA-E) ed emorragie (ARIA-H) che sono probabilmente correlati a risposte infiammatorie nel cervello quando l’anticorpo Aβ si lega ai recettori Fc (FCR ) di cellule immunitarie come microglia e macrofagi. Questi effetti collaterali infiammatori possono causare la morte delle cellule neuronali e l’eliminazione delle sinapsi da parte della microglia attivata e possono persino esacerbare il deterioramento cognitivo nei pazienti con AD.
Per superare questi problemi, un team di ricercatori del KAIST in Corea del Sud ha sviluppato un nuovo farmaco proteico di fusione, αAβ-Gas6, che elimina efficacemente l’Aβ attraverso un meccanismo completamente diverso rispetto all’immunoterapia a base di anticorpi Aβ. In un modello murino di Alzheimer, αAβ-Gas6 non solo ha rimosso l’Aβ con una potenza maggiore, ma ha anche aggirato gli effetti collaterali infiammatori neurotossici associati ai trattamenti anticorpali convenzionali.
I risultati dello studio sono stati pubblicati il 4 agosto su Nature Medicine.
“L’attivazione di FcR da parte di anticorpi mirati all’Aβ induce la fagocitosi Aβ mediata dalla microglia, ma produce anche segnali infiammatori, danneggiando inevitabilmente i tessuti cerebrali”, hanno affermato gli autori del documento Chan Hyuk Kim e Won-Suk Chung, Professori associati presso il Dipartimento di scienze biologiche del KAIST.
“Pertanto, abbiamo utilizzato l’efferocitosi, un processo cellulare mediante il quale le cellule morte vengono rimosse dai fagociti come percorso alternativo per la clearance dell’Aβ nel cervello”, hanno affermato il Prof. Kim e Chung. “L’efferocitosi è accompagnata da risposte antinfiammatorie per mantenere l’omeostasi tissutale. Per sfruttare questo processo, abbiamo ingegnerizzato Gas6, una proteina adattatrice solubile che media l’efferocitosi tramite i recettori fagocitici TAM in modo tale che la sua specificità bersaglio fosse reindirizzata dalle cellule morte alle placche Aβ“.
Vedi anche:Alzheimer: le fragole possono proteggere il cervello
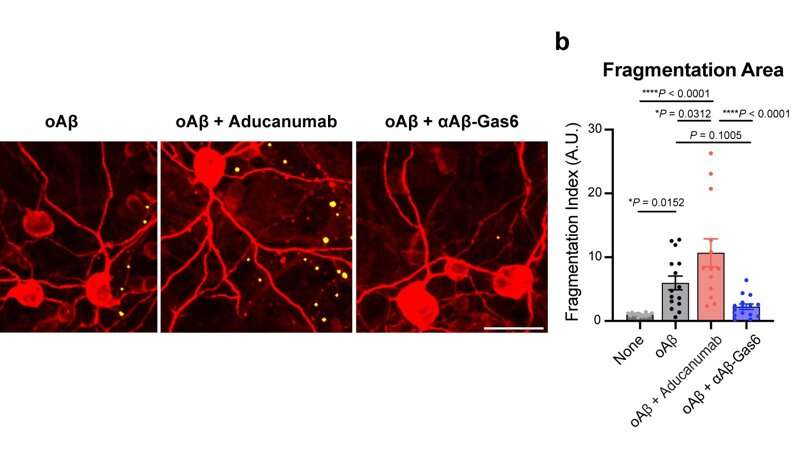
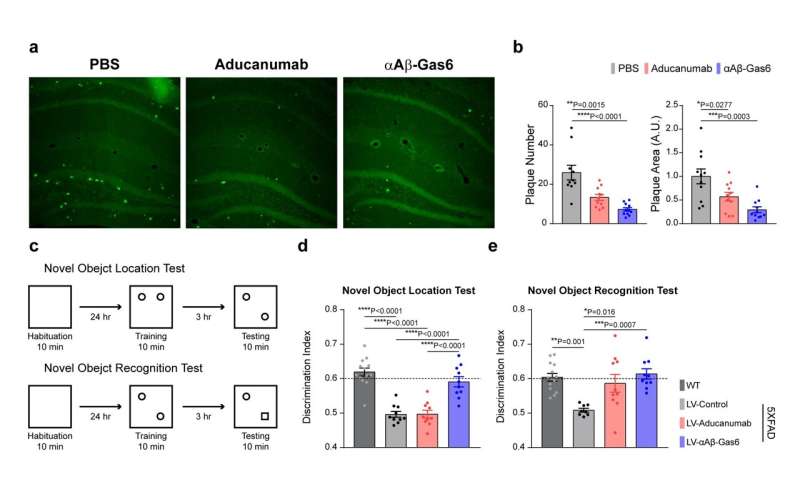
I Professori e il loro team hanno dimostrato che l’αAβ-Gas6 risultante ha indotto l’ingolfamento dell’Aβ attivando non solo la fagocitosi microgliale, ma anche astrocitica poiché i recettori fagocitici TAM sono altamente espressi da questi due principali fagociti nel cervello. È importante sottolineare che αAβ-Gas6 ha promosso il robusto assorbimento di Aβ senza mostrare alcun segno di infiammazione e neurotossicità, che contrasta nettamente con il trattamento che utilizza un anticorpo monoclonale Aβ. Inoltre, hanno dimostrato che αAβ-Gas6 riduceva sostanzialmente l’eccessiva eliminazione delle sinapsi da parte della microglia, portando di conseguenza a migliori salvataggi comportamentali nei topi modello AD.
“Utilizzando un modello murino di angiopatia amiloide cerebrale (CAA), un disturbo cerebrovascolare causato dalla deposizione di Aβ all’interno delle pareti dei vasi sanguigni del cervello, abbiamo anche dimostrato che la somministrazione intratecale della proteina di fusione Gas6 ha eliminato significativamente gli amiloidi cerebrovascolari, insieme a una riduzione delle microemorragie. Questi dati dimostrano che aAb-Gas6 è un potente agente terapeutico nell’eliminazione dell’Aβ senza esacerbare le microemorragie correlate alla CAA”.
I Professori Kim e Chung hanno osservato: “Riteniamo che il nostro approccio possa essere una svolta nel trattamento dell’Alzheimer senza causare effetti collaterali infiammatori e perdita di sinapsi. Il nostro approccio è promettente come una nuova piattaforma terapeutica applicabile a più dell’AD. Modificando la specificità del target della proteina di fusione, la proteina di fusione Gas6 può essere applicata a vari disturbi neurologici e malattie autoimmuni colpite da molecole tossiche che dovrebbero essere rimosse senza causare risposte infiammatorie“.
Fonte:Nature