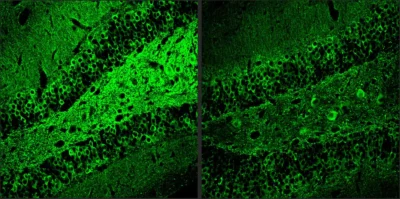
Alzheimer-Immagine: i ricercatori del Picower Institute hanno scoperto che una molecola chiamata A11 combatte l’infiammazione nel cervello causata dal morbo di Alzheimer. Ad esempio, i topi modello di Alzheimer trattati con A11 (a destra) hanno mostrato molta meno proteina tau (colorazione verde), un segno distintivo della patologia della malattia, rispetto ai controlli non trattati (a sinistra). Credito: immagine per gentile concessione del Tsai Lab/Picower Institute-
Un potenziale nuovo farmaco contro l’Alzheimer reprime la risposta infiammatoria dannosa delle cellule immunitarie del cervello, riducendo la patologia della malattia, preservando i neuroni e migliorando la cognizione nei test preclinici.
I ricercatori hanno fatto passi da gigante nel trattamento della malattia di Alzheimer riducendo la proteina beta-amiloide utilizzando alcuni farmaci. Tuttavia, permangono altri problemi legati alla malattia, come l’infiammazione. In un nuovo studio, gli scienziati del Picower Institute for Learning and Memory del MIT hanno introdotto un farmaco candidato che riduce l’infiammazione e migliora la memoria in colture cellulari umane e modelli murini di Alzheimer.
Targeting PU.1: una via da seguire
Il bersaglio della nuova molecola “A11” è un fattore di trascrizione genetica chiamato PU.1. Ricerche precedenti hanno dimostrato che nel morbo di Alzheimer, PU.1 diventa un direttore troppo zelante dell’espressione genica infiammatoria nelle cellule immunitarie della microglia del cervello.
La nuova ricerca mostra che A11 sopprime questa problematica attività PU.1 reclutando altre proteine che reprimono i geni infiammatori che PU.1 cerca di esprimere. Tuttavia, poiché A11 si concentra principalmente nel cervello, non sembra interferire con l’altro compito di PU.1, che è quello di garantire la produzione di un’ampia varietà di cellule del sangue.
“L’infiammazione è una componente importante della patologia dell’Alzheimer che è particolarmente difficile da trattare“, afferma l’autore senior dello studio Li-Huei Tsai, Professore di Neuroscienze Picower al MIT e Direttore del Picower Institute e della Aging Brain Initiative del MIT. “Questo studio preclinico dimostra che A11 riduce l’infiammazione nelle cellule simili alla microglia umana, così come in diversi modelli murini di malattia di Alzheimer e migliora significativamente la cognizione nei topi. Riteniamo quindi che A11 meriti ulteriore sviluppo e test”.
Tsai ed Elizabeta Gjoneska del National Institutes of Health sono autori co-corrispondenti dello studio pubblicato di recente sul Journal of Experimental Medicine.4
Basandosi su ricerche precedenti
Come postdoc, Gjoneska ha co-condotto uno studio del 2015 che ha implicato PU.1 come regolatore dell’infiammazione errante della microglia in un modello murino di malattia di Alzheimer. Quella ricerca è stata una collaborazione tra il laboratorio di Tsai e quello del Professore di informatica del MIT Manolis Kellis, co-guidato dall’ex postdoc Andreas Pfenning, ora membro della facoltà della Carnegie Mellon University. Da allora, Tsai ha cercato un modo sicuro per ripristinare l’attività PU.1 a livelli più sani.
Il lavoro descritto nel nuovo articolo, guidato dal ricercatore del Picower Institute, William Ralvenius, inizia con esperimenti per convalidare ulteriormente che PU.1 sarebbe un obiettivo terapeuticamente significativo. Per fare ciò, gli scienziati hanno confrontato l’espressione genetica nelle cellule immunitarie di campioni cerebrali post-mortem di pazienti affetti da Alzheimer e modelli murini e corrispondenti di controlli non affetti da Alzheimer.
I confronti hanno dimostrato che l’Alzheimer provoca importanti cambiamenti nell’espressione genica della microglia e che un aumento del legame di PU.1 ai bersagli genetici infiammatori era una componente significativa di tale cambiamento. Inoltre, hanno rivelato che la riduzione dell’attività PU.1 in un modello murino di Alzheimer riduce l’infiammazione e la neurodegenerazione, ovvero la morte dei neuroni.
Processo e risultati dello screening
Abbattere geneticamente PU.1 nel corpo non è una strategia terapeutica praticabile data la sua importanza per il normale funzionamento sano del corpo. Il team ha quindi esaminato più di 58.000 piccole molecole provenienti da archivi di farmaci approvati dalla FDA e nuove sostanze chimiche per vedere se qualcuno potesse ridurre in modo sicuro e significativo l’infiammazione chiave e i geni correlati all’Alzheimer regolati da PU.1 nelle colture cellulari. Dopo diversi cicli di screening sempre più rigorosi, i ricercatori hanno ristretto il campo a sei sostanze chimiche. A11 era di gran lunga il più potente tra queste.
I ricercatori hanno testato gli effetti delle dosi di A11 sulla funzione delle cellule simili alla microglia umana coltivate da cellule staminali di pazienti. Quando hanno esposto le cellule simili alla microglia a molecole immunitarie che tipicamente innescano l’infiammazione, le cellule trattate con A11 hanno mostrato una ridotta espressione e secrezione di citochine infiammatorie e minori cambiamenti nella forma del corpo cellulare associati alle risposte infiammatorie della microglia. Le cellule hanno mostrato anche un minore accumulo di molecole lipidiche, un altro segno di attivazione infiammatoria.
Osservando i modelli di espressione genetica, gli scienziati hanno osservato che le cellule trattate con A11 esposte a fattori scatenanti infiammatori si comportavano in modo molto simile alla microglia imperturbata, suggerendo che l’A11 aiuta a prevenire una reazione eccessiva della microglia ai segnali infiammatori.
Altri due test di laboratorio volti a comprendere come A11 esercita i suoi effetti hanno rivelato che non modifica i livelli di PU.1. Invece, contrasta l’attività PU.1 reclutando diverse proteine tra cui MECP2, HDAC1, SIN3A e DMNT3A, note per reprimere l’espressione dei suoi bersagli. In sostanza, nel morbo di Alzheimer, A11 riduce ciò che PU.1 amplifica.
“A11 rappresenta una molecola di prima classe che converte PU.1 da un attivatore trascrizionale a un repressore trascrizionale, determinando uno stato controllato di infiammazione microgliale“, scrivono gli autori.
Topi nei labirinti
Dopo aver stabilito che A11 riduce l’attività infiammatoria nella microglia e determinato come ciò accade, i ricercatori si sono concentrati sulla sua efficacia come medicinale nei modelli murini della malattia di Alzheimer.
Test farmacologici hanno indicato che l’A11 viene facilmente eliminato dai tessuti ed è in grado di raggiungere le cellule cerebrali. Inoltre, nei topi sani, la sostanza chimica ha attraversato con successo la barriera ematoencefalica ed è rimasta nelle cellule cerebrali molto più a lungo che altrove.
Infine, gli scienziati hanno testato gli effetti dei farmaci sulla patologia e sui sintomi della malattia di Alzheimer in tre ceppi di topi che modellano ciascuno aspetti diversi della malattia di Alzheimer: topi CK-p25 (neurodegenerazione grave), topi transgenici Tau P301S (taupatia) e topi 5XFAD (patologia amiloide).
Topi CK-p25 maschi e femmine con neurodegenerazione grave trattati con A11 hanno mostrato una risposta infiammatoria inferiore tra le cellule della microglia e degli astrociti e hanno perso meno neuroni rispetto ai controlli non trattati. I topi Tau P301S hanno risposto in modo simile, mostrando anche una significativa riduzione della proteina tau fosforilata nella regione dell’ippocampo del cervello, che è un’area essenziale per la memoria. Nei topi 5XFAD, l’amiloide era significativamente ridotta.
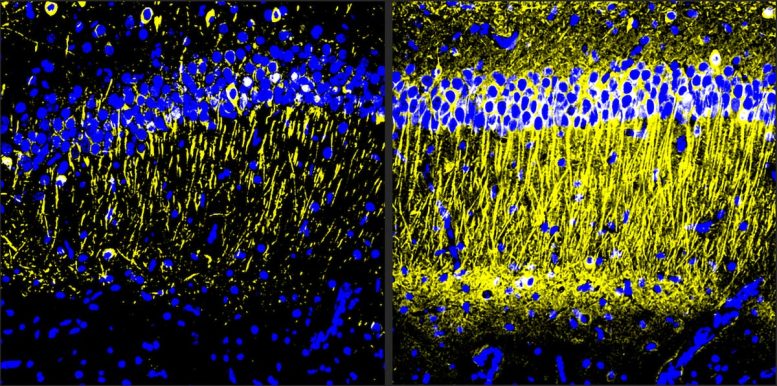
Il cervello dei topi modello di Alzheimer trattati con A11 (a destra) ha mostrato più tubulina (giallo), un indicatore di salute neuronale, rispetto ai controlli non trattati (a sinistra). Credito: immagine per gentile concessione del Tsai Lab/Picower Institute
Il gruppo di ricerca ha sottoposto i topi Tau P301S Tg e CK-p25 a labirinti progettati per testare la loro memoria di lavoro a breve termine e l’apprendimento a lungo termine. In entrambi i modelli e in entrambi i test, i topi trattati con A11 hanno ottenuto risultati significativamente migliori rispetto ai controlli non trattati. Ad esempio, nel “Morris Water Maze”, in cui i topi devono imparare la posizione di una piattaforma sommersa che consente loro di riposare, i topi trattati con CK-p25 hanno imparato molto più velocemente di quelli non trattati.
Leggi anche:Giornata mondiale dell’Alzheimer- 21 settembre
“Sono necessari molti più test prima che l’A11 possa diventare un medicinale approvato“, dice Tsai, “ma osserva che potrebbe integrare i nuovi trattamenti che prendono di mira l’amiloide“.
“Dato che A11 agisce attraverso un meccanismo distinto dalle terapie esistenti per il morbo di Alzheimer, A11 potrebbe essere usato da solo o in combinazione con terapie approvate per fornire opzioni di trattamento migliori per le malattie neurodegenerative“, concludono gli autori.
Fonte: Journal of Experimental Medicine
Fonte: