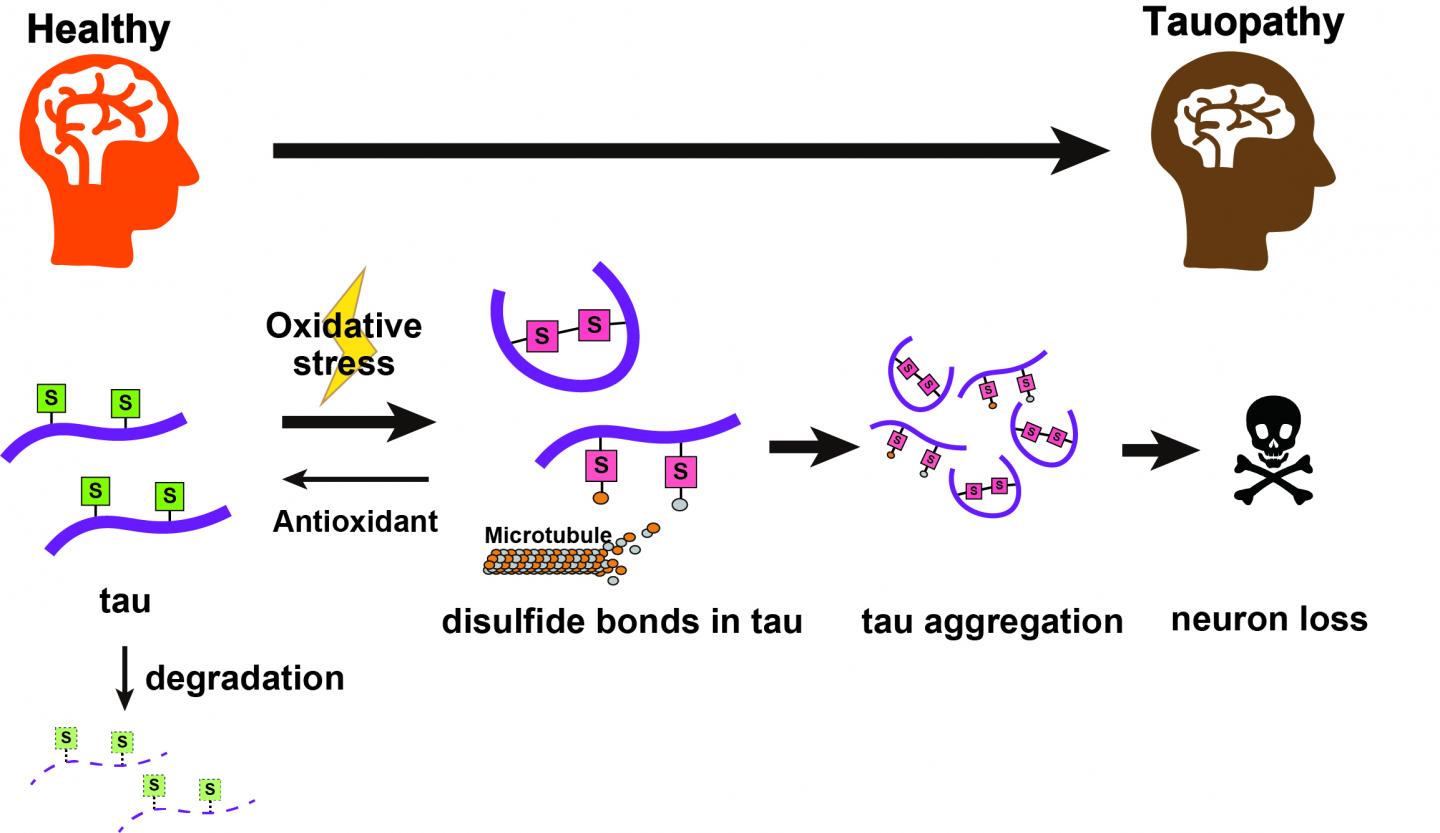
(Alzheimer-Immagine: le proteine tau con gruppi cisteina recanti gruppi tiolici (S) subiscono cambiamenti chimici sotto stress ossidativo per formare legami disolfuro, formando un mutante tossico della proteina tau che può aggregarsi. Questi continuano a causare la degenerazione neurale. Gli antiossidanti possono aiutare a ridurli a tioli; queste normali proteine tau possono quindi essere eliminate naturalmente dalla cellula). Credito: Università metropolitana di Tokyo Tokyo).
I riflettori sugli amminoacidi che causano la tossicità della proteina tau potrebbero portare a nuove terapie per la malattia di Alzheimer ed altre taupatie. La formazione di legami disolfuro nella proteina tau associata ai microtubuli promuove l’accumulo di tau e la tossicità in vivo.
I ricercatori della Tokyo Metropolitan University hanno scoperto che una caratteristica chimica specifica di una proteina chiave nota come tau può farla accumulare nel cervello e scatenare malattie come l’Alzheimer. Hanno scoperto che i legami disolfuro su alcuni amminoacidi agiscono per stabilizzare la tau e provocarne l’accumulo, un effetto che peggiora con l’aumento dello stress ossidativo. L’identificazione di bersagli chimici che innescano l’accumulo di tau può portare a trattamenti innovativi.
La proteina tau è fondamentale per la sana funzione delle cellule. Aiuta a formare e stabilizzare i microtubuli, i sottili filamenti che attraversano gli interni delle cellule per mantenerle strutturalmente rigidi e fornire “percorsi” per trasportare le molecole tra gli organelli. Tuttavia, quando non si forma correttamente, può accumularsi e formare grumi appiccicosi. Nel cervello, questi aggregati bloccano l’attivazione dei neuroni e causano una vasta gamma di malattie neurodegenerative note come taupatie, una delle quali è il morbo di Alzheimer. È estremamente importante che gli scienziati trovino “l’interruttore” che trasforma la tau da una parte indispensabile della funzione cellulare a una patologia mortale.
Vedi anche:Alzheimer e stress cronico: quale legame?
Un team guidato dal Professore associato Kanae Ando della Tokyo Metropolitan University ha utilizzato organismi modello come il moscerino della frutta Drosophila per scoprire come le caratteristiche specifiche della proteina tau ne impediscano il corretto funzionamento. Le mosche possono essere geneticamente modificate per esprimere la stessa proteina tau degli esseri umani. Modificando sistematicamente parti del gene che codifica per tau, i ricercatori hanno cercato di individuare come determinate caratteristiche delle proteine tau mutanti influenzino il loro comportamento.
Spiegano gli autori:
“Si pensa che l’accumulo di proteina tau associata ai microtubuli causi la perdita di neuroni in un gruppo di malattie neurodegenerative chiamate taupatie. Nei cervelli malati, le molecole tau adottano strutture patologiche che si propagano in forme insolubili con schemi specifici della malattia. È noto che diversi tipi di modificazioni post-traduzionali della tau modulano la sua propensione all’aggregazione in vitro , ma la loro influenza sull’accumulo di tau e sulla tossicità a livello dell’intero organismo non è stata completamente chiarita. Qui, abbiamo utilizzato una serie di Drosophila trans transgenichemodelli per confrontare sistematicamente la tossicità indotta da cinque costrutti tau con mutazioni o delezioni associate all’aggregazione, comprese sostituzioni in sette siti di fosforilazione associati alla malattia (S7A e S7E), delezioni di sequenze PHF6 e PHF6* (ΔPHF6 e ΔPHF6*) e sostituzioni di residui di cisteina nelle ripetizioni di legame ai microtubuli (C291/322A). Abbiamo scoperto che le sostituzioni e le delezioni hanno portato a diversi modelli di neurodegenerazione e accumulo, con C291/322A che ha un effetto drammatico sia sull’accumulo di tau che sulla neurodegenerazione. Queste cisteine hanno formato legami disolfuro nei neuroni primari di topo in coltura e nella retina dei moscerini e hanno stabilizzato le proteine tau. Inoltre, hanno contribuito all’accumulo di tau sotto stress ossidativo. Abbiamo anche scoperto che ciascuno di questi residui di cisteina contribuisce alla velocità di polimerizzazione dei microtubuli e ai livelli di equilibrio dei microtubuli, ma nessuno di essi ha influenzato il legame della tau ai microtubuli polimerizzati. Poiché le proteine tau espresse nella retina di Drosophila sono principalmente presente nelle prime fasi dell’autoassemblaggio dei filamenti di tau, i nostri risultati suggeriscono che la formazione di legami disolfuro da parte di questi residui di cisteina potrebbe essere bersagli terapeutici interessanti“.
Il team spera che la conoscenza esatta di quali gruppi chimici sono responsabili della tossicità della tau possa portare a nuove terapie che riducano o prevengano l’accumulo di tau, aiutando chi soffre di taupatie in tutto il mondo”.
Fonte:Human Molecular Genetics