(Alzheimer-Immagine Credit Public Domain).
I depositi di proteine nella retina e nel cervello sembrano mettere in parallelo la possibile neurodegenerazione, un’intuizione che potrebbe portare a un rilevamento più semplice e rapido dell’Alzheimer. Le placche amiloidi sono depositi proteici che si raccolgono tra le cellule cerebrali, ostacolando la funzione e portando infine alla morte neuronale. Sono considerati un segno distintivo della malattia di Alzheimer (AD) e al centro di molteplici indagini progettate per ridurre o prevenire la loro formazione, incluso lo studio nazionale A4.
Ma depositi di amiloide possono verificarsi anche nella retina dell’occhio, spesso in pazienti con diagnosi clinica di AD, suggerendo patologie simili. In un piccolo studio trasversale, un team di ricercatori, guidato da scienziati della University of California San Diego School of Medicine, ha confrontato i test sugli amiloidi retinici e cerebrali in pazienti dello studio A4 e un altro studio (Longitudinal Evaluation of Amyloid Risk and Neurodegenerazione) che valuta il rischio di neurodegenerazione in persone con bassi livelli di amiloide.
La retinita è stata chiamata la “finestre sul cervello”. I ricercatori hanno osservato che la presenza di macchie retiniche negli occhi era correlata alle scansioni cerebrali che mostravano livelli più elevati di amiloide cerebrale. La scoperta suggerisce che l’imaging retinico non invasivo può essere utile come biomarcatore per rilevare il rischio di AD in fase iniziale.
Spiegano gli autori:
“Gli sviluppi dei biomarcatori per l’Alzheimer, si sono concentrati sulla rilevazione della deposizione anormale di amiloide cerebrale nella fase preclinica della malattia (pAD). L’identificazione di soggetti asintomatici positivi all’amiloide è fondamentale per gli sforzi progettati per intervenire terapeuticamente nella pAD. Anche in questa prima fase preclinica si osserva un sottile declino cognitivo. I biomarcatori pAD attualmente approvati includono la tomografia a emissione di positroni con legante amiloide (PET) e i livelli di amiloide nel liquido cerebrospinale (CSF); entrambi gli approcci sono stati utilizzati per identificare gli individui con AD preclinico e in stadio successivo. L’uso diffuso di tali test è attualmente limitato a causa della spesa e dell’invasività di tali test. Lo sviluppo di ulteriori biomarcatori a basso costo e non invasivi per rilevare i cambiamenti patologici della pAD è una priorità nel campo. Coniata la “finestra sul cervello”, la retina può sviluppare caratteristiche patologiche simili a quelle osservate nel cervello negli stati di malattia neurodegenerativa, poiché entrambe provengono dagli stessi precursori embrionali. Valutazioni cliniche standard della retina in pazienti con malattie neurodegenerative, incluso l’AD, hanno mostrato alterazioni nel tessuto retinico e nel sistema vascolare, a sostegno di questa tesi. Diversi studi di imaging retinico di AD con pazienti diagnosticati clinicamente hanno trovato cambiamenti retinici mediati da AD, come l’assottigliamento dello strato neuronale retinico e alterazioni vascolari, attraverso la tomografia a coerenza ottica (OCT). Studi in popolazioni precliniche hanno anche osservato una riduzione dello strato neuronale retinico associata ad altri biomarcatori come l’amiloide del liquido cerebrospinale e l’amiloide-PET. In sintesi, questi studi implicano che la retina è suscettibile alla neurodegenerazione nello stato di AD.
Oltre all’assottigliamento della retina, sono state riportate patologie associate all’AD come le placche amiloidi extracellulari nel tessuto retinico dell’AD post mortem attraverso l’analisi istologica. Poiché la retina può essere monitorata in modo non invasivo, alcuni studi hanno cercato di rilevare la patologia retinica correlata alle placche amiloidi in tempo reale attraverso l’imaging del fondo retinico. Corpi di inclusione retinici sono stati osservati in una popolazione con una storia familiare di AD attraverso l’autofluorescenza BluePeak, con la superficie del corpo di inclusione che aumentava in funzione dei livelli di amiloide-PET. Le drusen dure, spesso associate alla degenerazione maculare senile (AMD), sono state identificate attraverso l’imaging retinico a campo ultra ampio in individui affetti da AD con diagnosi clinica e hanno anche dimostrato di espandersi nel tempo con la progressione della malattia. L’amiloide può essere contenuta nelle drusen, come si osserva nelle retine AMD. Questi risultati implicano che i depositi retinici associati all’amiloide possono svilupparsi nei pazienti con Alzheimer. La curcumina, un derivato fluorescente della curcuma, si lega alle placche di beta amiloide (Aβ) nei tessuti cerebrali di AD post mortem. L’analisi in vivo del laboratorio Koronyo che utilizza l’imaging del fondo oculare in persone pretrattate con supplementazione di curcumina ha identificato depositi marcati con curcumina nelle retine di pazienti con diagnosi di decadimento cognitivo lieve (MCI) e Alzheimer da lieve a moderata. Ad oggi, nessun altro laboratorio ha replicato queste osservazioni, né ci sono altri rapporti che abbiano condotto studi di imaging retinico per rilevare placche amiloidi retiniche marcate con curcumina”.
Vedi anche:Alzheimer: catalizzatore attacca la struttura amiloide
I risultati dello studio sono stati pubblicati nel numero del 17 agosto 2021 di Alzheimer’s & Dementia.
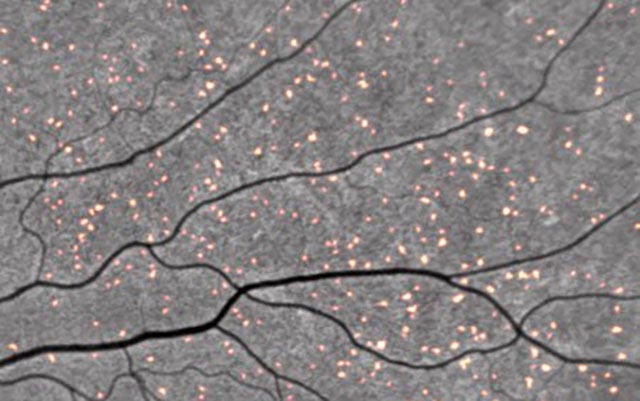
I depositi di amiloide marcati dalla curcumina emettono fluorescenza in una scansione retinica. Credito: NeuroVision
“Questo studio era un piccolo set di dati iniziali dalla visita di screening. Ha coinvolto otto pazienti”, ha detto l’autore senior Robert Rissman, PhD, Professore di neuroscienze presso la UC San Diego School of Medicine e Direttore del Biomarker Core per l’Alzheimer’s Disease Cooperative Study e il Shiley-Marcos Alzheimer’s Disease Research Center dell’UC San Diego. “Ma questi risultati sono incoraggianti perché suggeriscono che è possibile determinare l’insorgenza, la diffusione e la morfologia dell’AD – una diagnosi preclinica – utilizzando l’imaging retinico, piuttosto che scansioni cerebrali più difficili e costose. Non vediamo l’ora di vedere i risultati di ulteriori scansioni retiniche timepoint e l’impatto di Solanezumab (un anticorpo monoclonale) sull’imaging retinico. Sfortunatamente, dovremo aspettare per vedere e analizzare questi dati quando il processo A4 sarà completato”.
“Il prossimo passo”, ha detto Rissman, “sarà quello di condurre uno studio più ampio per documentare e accertare in modo più completo la relazione tra amiloide retinica e amiloide cerebrale, sia in sezione trasversale che nel tempo”.
Co-autori dell’articolo “Studio di fattibilità per il rilevamento dell’amiloide retinica negli studi clinici: lo studio Anti-Amyloid Treatment in Asymptomatic Alzheimer’s Disease (A4)” sono: Jennifer Ngolab, Michael Donohue, Alison Belsha, Jennifer Salazar, Paula Cohen, Sandhya Jaiswal, Veasna Tan, Devon Gessert, Shaina Korouri, Neelum T. Aggarwal, Jessica Alber, Ken Johnson, Gregory Jicha, Christopher van Dyck, James Lah, Stephen Salloway, Reisa A. Sperling, Paul S. Aisen, Michael S. Rafii e Robert A. Rissman.
Fonte:Alzheimer’s & Dementia