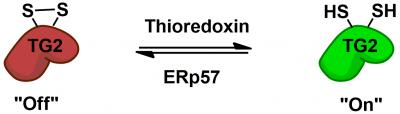
Immagine: la transglutaminasi 2 (TG2) è regolata in modo reversibile dai cofattori di proteine thioredoxin ed ERp57 tramite un interruttore redox disolfuro allosterico. Credit: Chaitan Khosla, Stanford University.
I ricercatori della Stanford University hanno scoperto come una proteina associata alla celiachia può essere inattivata, aprendo le porte a possibili nuovi trattamenti.
La celiachia è una malattia autoimmune che colpisce secondo alcune stime circa 1 persona su 100. I sintomi della malattia celiaca sono innescati dal glutine, una proteina presente nel grano e piante correlate, ma il glutine non agisce da solo per causare i sintomi che i pazienti sviluppano. Piuttosto, il glutine induce una risposta immunitaria iperattiva quando viene modificato dall’enzima transglutaminasi 2, o TG2, nell’intestino tenue.
Una nuova ricerca pubblicata nel numero del 23 febbraio del Journal of Biological Chemistry identifica un enzima che spegne l’ attività di TG2, aprendo potenzialmente la strada a nuovi trattamenti per la malattia celiaca.
( Vedi anche:La celiachia è più di un’ intolleranza al glutine).
“Attualmente mancano le terapie per curare le persone celiache e l’approccio migliore in questo momento è solo una stretta aderenza a una dieta senza glutine per tutta la vita”, ha detto Michael Yi, uno studente laureato in ingegneria chimica alla Stanford University che ha guidato il nuovo studio. “Forse la ragione di questo è la nostra comprensione relativamente scarsa del ruolo dell’enzima TG2”.
La biochimica di come il TG2 interagisce con il glutine e induce una risposta immunitaria è stata ben studiata, ma restano ancora misteri di base, ad esempio come si comporta TG2 in persone senza celiachia. Chaitan Khosla, Professore alla Stanford e Direttore di Stanford Chemistry, Engineering & Medicine for Human Health che ha supervisionato il nuovo studio, ha condotto diversi studi che dimostrano che TG2 può essere attivo o inattivo, a seconda della formazione o della rottura di un legame chimico specifico, chiamato un legame disolfuro, tra due aminoacidi nell’enzima.
“Quando è diventato chiaro che anche se la proteina è abbondante, la sua attività era inesistente in un organo sano, la domanda diventava: ” Cosa accende alla proteina e quindi cosa la trasforma ?”.
Nel 2011, il team di Khosla ha identificato l‘enzima che attiva TG2 rompendo il suo legame disolfuro. Nel nuovo documento, i ricercatori hanno eseguito esperimenti su colture cellulari e trovato un enzima che riformula questo legame, inattivando TG2. Questo enzima, ERp57, è noto principalmente per aiutare a piegare le proteine all’interno della cellula. Quando spegne TG2, lo fa al di fuori delle cellule, sollevando più domande sulle sue funzioni nelle persone sane.
“Nessuno sa veramente come Erp57 esce dalla cellula“, ha detto Khosla. “Il pensiero generale è che viene esportato dalla cellula in piccole quantità, questa particolare osservazione suggerisce che in realtà ha un ruolo biologico al di fuori della cellula“.
L’enzima TG2 è la prima proteina nota per avere un interruttore on / off di tipo reversibile, con legami disolfuro.
La comprensione di questo meccanismo ha portato il team a verificare se esistono farmaci approvati dalla FDA che potrebbero indirizzare direttamente “l’ interruttore” dell’enzima. Poiché studi precedenti hanno suggerito che la mancanza di TG2 non sembra influire negativamente sulla salute dei topi, il blocco di TG2 è una via promettente per il trattamento dei pazienti affetti da celiachia senza richiedere modifiche permanenti alla loro dieta.