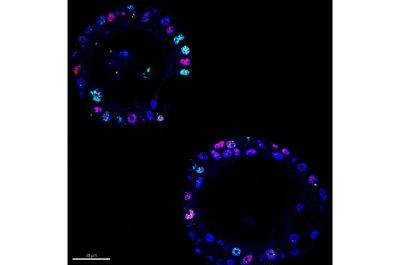
Cancro al pancreas-immagini di immunofluorescenza che mostrano che le cellule con livelli più elevati della proteina MYC che promuove il cancro (rosso) tendono anche a mostrare livelli elevati di danno al DNA (verde), il che suggerisce che troppo MYC porta a stress genomico. Credito: Vincenzo Corbo Lab.
Il cancro al pancreas è uno dei tumori più letali al mondo, con un tasso di sopravvivenza a cinque anni del 13%. Questa prognosi sfavorevole deriva sia dalla diagnosi tardiva sia dalla nota capacità del cancro di adattarsi e resistere alla terapia.
Ora, uno studio condotto da ricercatori dell’Università di Verona, dell’Università di Glasgow e del Botton-Champalimaud Pancreatic Cancer Center ha scoperto un fattore nascosto di questa adattabilità: il DNA extracromosomico (ecDNA).
I risultati dello studio sono stati pubblicati su Nature.
Un nuovo protagonista nel cancro al pancreas
Il team ha scoperto che alcune cellule tumorali del pancreas ottengono un importante vantaggio in termini di sopravvivenza trasportando copie di geni tumorali critici, come MYC, su porzioni circolari di DNA che si trovano all’esterno dei cromosomi, le strutture che ospitano la maggior parte del nostro materiale genetico.
Conosciuti come ecDNA, questi anelli genetici fluttuano liberamente nel nucleo cellulare, consentendo alle cellule tumorali di aumentare rapidamente l’espressione genica, cambiare forma e sopravvivere in ambienti altrimenti ostili.
“Il cancro al pancreas è spesso definito un killer silenzioso perché è difficile da individuare prima che sia troppo tardi“, afferma Peter Bailey, coautore corrispondente e direttore della ricerca traslazionale presso il Botton-Champalimaud Pancreatic Cancer Center. “Sappiamo che parte della sua letalità deriva dalla capacità delle cellule tumorali di ‘cambiare forma’ sotto stress. Il nostro studio dimostra che l’ecDNA costituisce una parte importante di questa storia“, aggiunge.
I ricercatori hanno scoperto che l’ecDNA è sorprendentemente comune nei tumori del pancreas, in particolare per oncogeni come MYC, che guidano la crescita e il metabolismo del cancro.
“Abbiamo visto una variabilità molto maggiore nel numero di copie di MYC quando MYC era su ecDNA”, spiega Elena Fiorini, co-prima autrice e postdoc senior. “Alcune cellule trasportavano dozzine, o addirittura centinaia, di copie extra di MYC, il che conferiva loro un grande vantaggio di crescita in determinate condizioni“.
“Si tratta in effetti di una strategia di ‘copertura delle scommesse’“, aggiunge Daniel Schreyer, coautore principale ed ex dottorando presso l’Università di Glasgow.
“Si ottengono sacche di cellule che trasportano livelli molto elevati di MYC, il che è benefico in determinate condizioni e altre con meno copie che potrebbero funzionare meglio in un altro ambiente, tutte all’interno dello stesso tumore“.
Tale flessibilità sottolinea la profonda eterogeneità intratumorale caratteristica del cancro al pancreas, dove una miriade di sottopopolazioni coesistono e rispondono in modo diverso al trattamento. Prendere di mira un sottoinsieme spesso fallisce contro un altro, alimentando la resistenza.
Un vantaggio fondamentale di questo studio è che gli organoidi, ovvero mini-repliche 3D di tumori pancreatici coltivati in laboratorio, sono stati derivati direttamente da pazienti con malattia in fase iniziale. Questi organoidi conservano gran parte del patrimonio genetico del tumore originale, rendendoli eccellenti banchi di prova per lo studio del cancro. A differenza dei metodi che introducono artificialmente l’ecDNA, questi modelli di laboratorio riflettono le varianti autentiche dell’ecDNA trovate nei tumori reali.
“Questo approccio offre una visione concreta di quanto dinamico e disordinato possa essere un tumore“, afferma Fiorini. “Vediamo in prima persona che anche quando due pazienti hanno entrambi MYC su ecDNA, la struttura di quel DNA circolare può differire sostanzialmente, portando a grandi variazioni nell’espressione di MYC“.
Plasticità in azione: organoidi in laboratorio
Per vedere come l’ecDNA guida l’adattamento, i ricercatori hanno coltivato organoidi derivati dai pazienti e hanno rimosso segnali di crescita vitali, come i fattori WNT, per poi osservare come questi organoidi rispondevano allo stress.
“Abbiamo scoperto che gli organoidi che portano MYC sul DNA extracromosomico potrebbero modificare la loro dipendenza da WNT“, spiega Antonia Malinova, co-prima autrice ed ex studentessa presso l’Università di Verona. “In sostanza, le cellule con alti livelli di ecDNA sono diventate più autosufficienti, non avendo più bisogno di quei segnali esterni per sopravvivere”.
Lo studio ha anche rivelato un chiaro collegamento tra alti livelli di MYC e cambiamenti nella forma e nel comportamento delle cellule tumorali. Quando i livelli di ecDNA MYC sono saliti alle stelle, le cellule si sono trasformate in strutture più aggressive e solide, perdendo la loro architettura più organizzata, simile a una ghiandola.
“Ciò che è notevole“, afferma l’autore correlato Vincenzo Corbo dell’Università di Verona, “è la rapidità con cui queste copie basate sull’ecDNA possono apparire o scomparire a seconda dell’ambiente. Se il cancro è sotto pressione, ad esempio, privo di fattori di crescita chiave, le cellule con ecDNA possono aumentare l’espressione di MYC per sopravvivere. Ma se la pressione diminuisce, possono perdere alcuni di questi cerchi di DNA extra per evitare gli svantaggi di trasportare troppe copie“.
Infatti, l’espressione di MYC a livelli elevati può innescare danni al DNA, costringendo le cellule tumorali a bilanciare attentamente i costi e i benefici della conservazione dell’ecDNA.
“È stato inaspettato“, afferma Corbo. “lo studio mette in discussione l’assunto che più MYC sia sempre meglio per una cellula cancerosa: mantenere livelli così elevati comporta un costo reale per la forma fisica“.
ecDNA come bersaglio terapeutico?
Sebbene il DNA extracromosomico compaia solo nel 15% circa dei campioni di pazienti in questo studio, quel sottoinsieme potrebbe essere particolarmente aggressivo o incline alla resistenza alla terapia. Di conseguenza, rilevare o interrompere l’ecDNA potrebbe aprire nuove finestre terapeutiche.
“Potremmo immaginare una strategia che sfrutti le vulnerabilità introdotte dall’ecDNA“, nota Corbo. “Forse spingendo le cellule cancerose a comporre MYC fino a un punto in cui non riescono a gestire il danno al DNA, o bloccando i circuiti molecolari che mantengono questi anelli di DNA in modo che le cellule li perdano del tutto”.
Tuttavia, gli autori avvertono che tali idee sono ancora in fase iniziale. “L’ecDNA è un’arma a doppio taglio: utile per un rapido adattamento, ma costosa da mantenere“, afferma Corbo. “La sfida è far pendere l’ago della bilancia a favore del paziente”.
In modo cruciale, questo lavoro amplia la nostra comprensione della plasticità genomica, sfidando l’idea che il genoma sia sempre “fisso”.
Leggi anche:Cancro al pancreas: stress cronico e obesità tra le cause
“Sapevamo che l’ambiente circostante il tumore poteva guidare i cambiamenti, ma non che la segnalazione WNT potesse riscrivere così direttamente il DNA”, aggiunge Bailey. “Pensavamo che avremmo visto principalmente cambiamenti epigenetici, quindi vedere questo livello di re-ingegnerizzazione genomica è stata sicuramente una sorpresa“.
E poiché nei prossimi anni si prevede un aumento dei casi di cancro al pancreas, le conoscenze sul ruolo dell’ecDNA potrebbero orientare le strategie future per intercettare o sfruttare questa caratteristica genetica, rendendo potenzialmente i tumori più vulnerabili al trattamento.
Fonte:Nature