Cancro immagine credit public domain.
Prove accumulate hanno implicato l’influenza varia e sostanziale del lattato sulla differenziazione cellulare e sulla regolazione del destino in contesti fisiologici e patologici, in particolare in condizioni complesse come il cancro.
In particolare, è stato dimostrato che il lattato è fondamentale nel modellare il microambiente tumorale (TME) attraverso i suoi effetti su diverse popolazioni cellulari. All’interno delle cellule tumorali, il lattato ha un impatto sui percorsi di segnalazione cellulare, aumenta il processo di navetta del lattato, aumenta la resistenza allo stress ossidativo e contribuisce alla lattilazione.
In varie popolazioni cellulari, l’interazione tra lattato e cellule immunitarie regola processi come la differenziazione cellulare, la risposta immunitaria, la sorveglianza immunitaria e l’efficacia del trattamento. Inoltre, la comunicazione tra lattato e cellule stromali/endoteliali supporta il rimodellamento della membrana basale (BM), le transizioni epiteliali-mesenchimali (EMT), la riprogrammazione metabolica, l’angiogenesi e la resistenza ai farmaci.
Concentrarsi sulla produzione e il trasporto del lattato, in particolare attraverso i trasportatori della lattato deidrogenasi (LDH) e dei monocarbossilati (MCT), ha mostrato risultati promettenti nel trattamento del cancro. La revisione sottolinea l‘importanza del lattato nella progressione del tumore e fornisce preziose prospettive su potenziali approcci terapeutici che prendono di mira la vulnerabilità del metabolismo del lattato, evidenziando il tallone d’Achille per il trattamento del cancro.
La secrezione di lattato è ampiamente riconosciuta come un classico segno distintivo metabolico del cancro, spesso definito effetto Warburg. Questo fenomeno descrive la preferenza delle cellule tumorali a favorire la glicolisi per la produzione di energia, anche in presenza di ossigeno, portando a una maggiore produzione di lattato. Studi recenti non solo hanno confermato questa comprensione, ma hanno anche approfondito il ruolo del lattato nell’inizio e nella progressione del cancro, evidenziando i suoi contributi multiformi oltre a essere semplicemente un sottoprodotto del metabolismo cellulare.
La visione tradizionale del lattato come prodotto di scarto è stata messa in discussione da una ricerca innovativa che impiega tecniche di imaging avanzate come la tomografia a emissione di positroni con 18 F-fluorodesossiglucosio (FDG-PET). Uno studio fondamentale di Ralph De Berardinis Direttore, McDermott Center for Human Growth and Development, UT Southwestern et al., ha dimostrato che il lattato funge da nutriente vitale per le regioni tumorali, il che altera fondamentalmente la percezione del suo ruolo nella biologia del cancro.
In esperimenti che coinvolgono xenotrapianti di carcinoma polmonare non a piccole cellule (NSCLC) nei topi, i ricercatori hanno iniettato sia 13 C-glucosio che 13 C-lattato. Hanno scoperto che i metaboliti derivati dal 13 C-lattato nel ciclo dell’acido tricarbossilico (TCA), come citrato, glutammato e malato, sono risultati essere due volte più abbondanti rispetto a quelli derivati dal glucosio.
Questa osservazione sottolinea la nozione che il lattato può fungere da substrato più centrale e diretto nel ciclo TCA, un ruolo che è stato corroborato anche nei tessuti sani e nei modelli di cancro al polmone e al pancreas geneticamente modificati.
Nel contesto delle cellule tumorali, la navetta del lattato, che facilita lo scambio di lattato tra regioni tumorali anossiche e aerobiche, svolge un ruolo cruciale nella sorveglianza del tumore e nell’adattamento alle mutevoli condizioni metaboliche. Inoltre, il lattato ha un impatto sui percorsi di segnalazione sia intracellulari che extracellulari all’interno delle cellule tumorali, evidenziando la sua influenza sul comportamento delle cellule cancerose e sulla risposta alla terapia.
Inoltre, una pietra miliare significativa nella ricerca sul lattato è la scoperta della lattilazione, una modifica post-traduzionale che sottolinea l’intersezione tra metabolismo ed epigenetica.
“La lattilazione non è limitata alle proteine istoniche; si estende alle proteine non istoniche, influenzando così una varietà di processi cellulari. Questa modifica migliora l’interazione tra stati metabolici e regolazione epigenetica, accelerando l’insorgenza del tumore, la proliferazione, la metastasi e lo sviluppo della resistenza ai farmaci. La lattilazione indotta dal lattato opera attraverso molteplici meccanismi molecolari e percorsi di segnalazione, spesso intersecando altre modifiche epigenetiche per promuovere un fenotipo maligno”, spiegano gli autori.
Leggi anche:L’assorbimento degli acidi grassi migliora la lotta al cancro
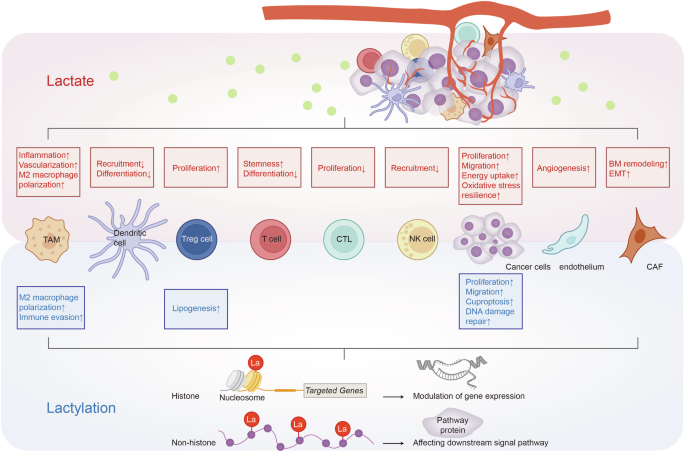
Questa revisione chiarisce il circuito e il ruolo fisico del lattato, ordina i meccanismi molecolari del lattato nella progressione del tumore e descrive strategie mirate al lattato per il trattamento del tumore, che rafforzano e specificano le potenti implementazioni del lattato nelle applicazioni cliniche e nel miglioramento della prognosi (Fig. 1 ).
La terapia mirata a lattato/lattilazione sta per tallone d’Achille per il trattamento del cancro. La terapia mirata a lattato/lattilazione attenua l’impatto del lattato/lattilazione sulla riprogrammazione onco-metabolica e sul rimodellamento del microambiente tumorale (TME), sottolineando il tallone d’Achille per il trattamento del cancro. Generato utilizzando Adobe Illustrator (versione 28.2). Abbreviazioni: membrana basale BM, fibroblasti associati al cancro CAF; transizioni epitelio-mesenchimali EMT; lattato deidrogenasi A LDHA.
Fonte: Nature