Neuroblastoma-Immagine: la chelazione del rame potenzia l’attività antitumorale dell’immunoterapia anti-GD2. Credito: Nature Communications (2024).
La chelazione del rame reindirizza la funzione dei neutrofili per migliorare la terapia con anticorpi anti-GD2 nel neuroblastoma.
Il neuroblastoma è una neoplasia maligna del sistema nervoso simpatico e rappresenta il 15% di tutti i decessi infantili correlati al cancro. Nonostante la terapia multimodale intensiva, la prognosi per i pazienti ad alto rischio rimane scarsa. Mentre l’integrazione dell’anticorpo anti-disialoganglioside (GD2) (ad esempio, dinutuximab) nella terapia di mantenimento ha dimostrato di migliorare sostanzialmente la sopravvivenza ed è ora uno standard di cura, quasi la metà dei pazienti rimane refrattaria o sviluppa resistenza al trattamento. Inoltre, la maggior parte dei sopravvissuti mostra un rischio aumentato di mortalità tardiva, neoplasie secondarie e altre condizioni di salute croniche. Pertanto, migliorare l’efficacia a lungo termine di questa promettente immunoterapia rimane un’importante sfida irrisolta.
Un giorno, il tasso di sopravvivenza dei bambini affetti da neuroblastoma, un tumore raro, ma mortale, potrebbe essere migliorato aggiungendo al trattamento un farmaco già esistente, attualmente utilizzato per gestire l’eccesso di rame nell’organismo.
Il farmaco può essere utilizzato per indebolire i tumori e rafforzare la capacità di lotta delle cellule immunitarie, aumentando il tasso di successo di un trattamento contro il neuroblastoma ad alto rischio dal 10% al 50%, come dimostra una nuova ricerca sui topi condotta dall’UNSW Sydney.
I risultati dello studio, pubblicati su Nature Communications, offrono speranza ai malati di neuroblastoma, responsabile del 15% dei decessi infantili per cancro.
Nonostante i trattamenti aggressivi, i bambini a cui viene diagnosticato un neuroblastoma ad alto rischio hanno 1 possibilità su 2 di sopravvivere alla malattia. Questa probabilità scende a 1 su 10 per i bambini che hanno una ricaduta.
“Per questi bambini, l’ultima possibilità è la terapia con anticorpi anti-GD2″, ha affermato il ricercatore principale e autore principale del rapporto, il Professore associato Orazio Vittorio, della Facoltà di Scienze Biomediche e del Children’s Cancer Institute dell’UNSW. “È una delle terapie più importanti sviluppate, ma funziona solo se c’è un sistema immunitario forte”, ha detto il Prof. A/Vittorio.
Ecco dove entra in gioco il farmaco TETA (trietilentetrammina), commercializzato come Cuprior. Sebbene attualmente utilizzato per trattare la malattia di Wilson, un disturbo genetico che provoca un accumulo eccessivo di rame, è stato utilizzato nei modelli animali per indebolire i neuroblastoma e rafforzare i neutrofili, un tipo di globuli bianchi che aiuta il corpo a combattere le infezioni e a guarire le ferite, trasferendo il rame dall’uno all’altro.
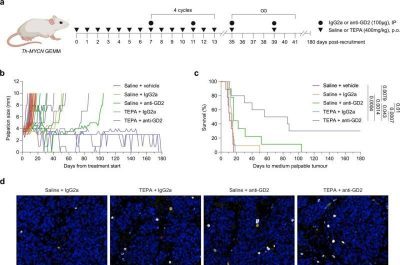
“Questo farmaco ha il duplice effetto di indebolire il tumore e di rafforzare il sistema immunitario, rendendolo più forte e in grado di reagire”, ha affermato il Prof. A/Vittorio.“Se lo associamo all’immunoterapia attualmente utilizzata per il neuroblastoma, possiamo aumentare il tasso di sopravvivenza nei casi ad alto rischio dal 10% al 50%”.
Il Prof. Vittorio paragona l’effetto del farmaco alla leggenda di Robin Hood.
“Il tumore è come questo riccone avido che sostanzialmente prende i soldi, o in questo caso il rame, dalle cellule immunitarie, rendendole molto deboli. Poi arriva il farmaco, il nostro Robin Hood, ruba il rame e lo restituisce alle cellule immunitarie, così possono diventare più forti e combattere“.
Il Prof. A/Vittorio ha sottolineato che aumentare l’assunzione di rame tramite cambiamenti nella dieta o integratori non avrebbe lo stesso effetto.
“Non aumentare mai il livello di rame che stai assumendo se hai un tumore, perché senza questo farmaco, tutto il rame in più disponibile raggiungerà il tumore e lo renderà più forte“.
I ricercatori, provenienti da una dozzina di istituzioni, tra cui il Children’s Cancers Institute, la University of Western Australia, la Curtin University e il Sydney Children’s Hospital Network, hanno testato il farmaco sui topi e prevedono di avviare una sperimentazione clinica pluriennale l’anno prossimo.
L’autore principale dello studio, il Dott. Jourdin Rouaen, della Facoltà di Medicina Clinica e del Children’s Cancer Institute dell’UNSW, spera che la terapia combinata possa un giorno migliorare il tasso di sopravvivenza e la qualità della vita dei bambini affetti da neuroblastoma.
“La terapia chelante del rame rappresenta un’evoluzione significativa rispetto ai trattamenti tradizionali contro il cancro. Non è tossica, non ha mostrato effetti collaterali preoccupanti ed è già approvata per l’uso“, ha affermato il Dott. Rouaen.
“I risultati mettono inoltre in luce l’importante ruolo che possono svolgere i neutrofili, spesso trascurati, su cui sono necessarie ulteriori ricerche per determinare come possano essere sfruttati per le immunoterapie in futuro“, ha aggiunto il Dott. Rouaen.
Si spera che il farmaco, se dimostrato efficace negli studi clinici, possa diventare parte integrante del trattamento di routine dell’immunoterapia nei prossimi anni.
Spiegano gli autori:
“Nello studio attuale, segnaliamo che la chelazione del rame è una strategia adiuvante efficace per potenziare la terapia anti-GD2 in due modelli immunocompetenti preclinici ( Th-MYCN ; NXS2) di neuroblastoma. Dimostriamo che la chelazione del rame altera favorevolmente l’infiltrazione e l’attività antitumorale di compartimenti sia linfoidi che mieloidi, in particolare neutrofili. Caratterizziamo un meccanismo di evasione immunitaria del tumore in cui il sequestro del rame determina la disfunzione dei neutrofili. In modo importante, stabiliamo TETA (trietilentetrammina, commercializzata come Cuprior), un agente chelante del rame approvato dalla FDA per la malattia di Wilson, come un agente immunomodulatore innovativo da riutilizzare come adiuvante alla terapia anti-GD2. Insieme, i nostri risultati forniscono prove cruciali a supporto della sperimentazione clinica di questa terapia di combinazione basata sul sistema immunitario per i pazienti con neuroblastoma”.
Leggi anche:Neuroblastoma: promettente inibizione della proteina METTL3
“Solitamente occorrono dagli otto ai tredici anni di ricerca per sviluppare un nuovo farmaco contro il cancro e i costi ammontano in media a 4,7 miliardi di dollari”, ha affermato il Dott. Rouaen. “Riutilizzando un farmaco esistente risparmiamo un sacco di soldi e di tempo, il che è particolarmente importante quando si cerca di migliorare il trattamento di questo tumore infantile mortale”.
Fonte: Nature Communications