Sclerosi multipla-Immagine: M1R + OPC sono presenti in sezioni di tessuto cerebrale di ratto e umano. Credito: Proceedings of the National Academy of Sciences (2024).
La sclerosi multipla (SM) degrada l’isolamento protettivo attorno alle cellule nervose, lasciando i loro assoni, che trasportano gli impulsi elettrici, esposti come fili scoperti. Ciò può causare problemi devastanti con il movimento, l’equilibrio e la vista e senza trattamento, può portare a paralisi, perdita di indipendenza e una durata di vita ridotta.
Ora, gli scienziati della UC San Francisco e della Contineum Therapeutics hanno sviluppato un farmaco che stimola il corpo a sostituire l’isolamento perduto, che si chiama mielina. Se funziona nelle persone, potrebbe essere un modo per invertire il danno causato dalla malattia.
La nuova terapia, chiamata PIPE-307, ha come bersaglio un recettore sfuggente su alcune cellule del cervello che le spinge a maturare in oligodendrociti produttori di mielina. Una volta bloccato il recettore, gli oligodendrociti entrano in azione, avvolgendosi attorno agli assoni per formare una nuova guaina mielinica.
Era fondamentale dimostrare che il recettore, noto come M1R, era presente sulle cellule che possono riparare le fibre danneggiate. Lo scienziato del Continoum e primo autore Michael Poon, Ph.D., lo ha capito usando una tossina trovata nel veleno del serpente mamba verde.
Il lavoro, che appare il 2 agosto su Proceedings of the National Academy of Sciences, corona un decennio di lavoro degli scienziati dell’UCSF Jonah Chan, Ph.D., e Ari Green, MD. Chan ha guidato il team alla scoperta nel 2014 che un oscuro antistaminico noto come clemastina poteva indurre la rimielinizzazione, cosa che nessuno sapeva fosse possibile.
“Dieci anni fa, abbiamo scoperto un modo in cui il corpo può rigenerare la sua mielina in risposta al giusto segnale molecolare, riducendo le conseguenze della SM“, ha affermato Chan, Professore di neurologia Debbie and Andy Rachleff presso l’UCSF e autore principale del documento. “Studiando attentamente la biologia della rimielinizzazione, abbiamo sviluppato una terapia precisa per attivarla, la prima di una nuova classe di terapie per la SM“.
Un farmaco che crea un’apertura
La svolta originale arrivò quando Chan inventò un metodo per esaminare i farmaci in base alla loro capacità di indurre la rimielinizzazione. Lo screening identificò un gruppo di farmaci, tra cui la clemastina, che avevano una cosa in comune: bloccavano i recettori muscarinici.
“I benefici della Clemastine iniziano con il suo effetto sulle cellule precursori degli oligodendrociti (OPC). Queste cellule rimangono dormienti nel cervello e nel midollo spinale finché non percepiscono un tessuto danneggiato. Poi si spostano e danno origine agli oligodendrociti, che producono mielina”, spiegano gli autori.
Per qualche ragione, durante la SM, gli OPC si raccolgono attorno alla mielina in decomposizione, ma non riescono a ricostruirla. Chan ha scoperto che la clemastina attiva gli OPC bloccando i recettori muscarinici, consentendo agli OPC di maturare in oligodendrociti produttori di mielina.
I nervi e la loro mielina sono notoriamente difficili da riparare, sia a causa della Sclerosi multipla, della demenza o di altre lesioni. Green e Chan hanno condotto uno studio sulla clemastina su pazienti con Sclerosi multipla e hanno avuto successo: è stata la prima volta che un farmaco ha mostrato la capacità di ripristinare la mielina persa nella SM. Nonostante fosse sicuro da usare, tuttavia, la clemastina è stata solo modestamente efficace.
“La clemastina non è un farmaco mirato, che agisce su diversi percorsi nel corpo”, ha affermato Green, capo della Divisione di neuroimmunologia e biologia gliale presso il Dipartimento di neurologia dell’UCSF e coautore del documento. “Ma fin dall’inizio, abbiamo visto che la sua farmacologia con recettori muscarinici potrebbe indirizzarci verso la prossima generazione di terapie rigenerative nella SM“.
Una tossina del veleno di serpente illumina il bersaglio giusto
I ricercatori hanno continuato a usare la clemastina per comprendere il potenziale curativo della rigenerazione della mielina nella SM. Hanno sviluppato una serie di strumenti per monitorare la rimielinizzazione, sia nei modelli animali di SM che nei pazienti con SM, dimostrando che i benefici osservati con la clemastina derivavano dalla rimielinizzazione e indicando la strada per il modo in cui i nuovi farmaci dovrebbero essere testati e valutati.
Hanno anche scoperto che i benefici della clemastina derivavano dal blocco di uno solo dei cinque recettori muscarinici, M1R, ma l’effetto su M1R era mediocre e il farmaco influenzava anche gli altri recettori. Il farmaco ideale dovrebbe concentrarsi su M1R.
A questo punto, gli scienziati dell’UCSF avevano bisogno di un partner industriale per far progredire il progetto. Alla fine, è stata fondata la Contineum Therapeutics (allora nota come Pipeline Therapeutics) per adottare un approccio meticoloso alla creazione di quel farmaco ideale. Chan e Green hanno aiutato l’azienda a confermare che M1R era il bersaglio giusto per un farmaco rimielinizzante e poi a creare un farmaco che lo bloccasse esclusivamente.
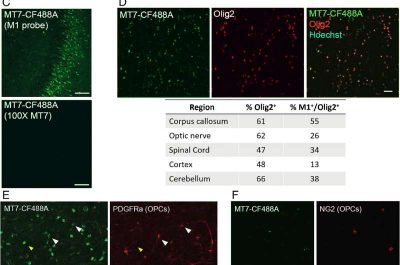
Poon, un biologo del Contineum, si rese conto che la MT7, una tossina presente nel veleno del mortale serpente mamba verde, poteva rivelare esattamente dove si trovava M1R nel cervello.
“Avevamo bisogno di provare, senza ombra di dubbio, che M1R era presente in OPC che erano vicine al danno causato dalla Sclerosi multipla“, ha detto Poon. “MT7, che è squisitamente selettivo per M1R, era perfetto”.
Poon ha utilizzato MT7 per progettare un’etichetta molecolare per M1R che ha rivelato anelli di OPC che si raccolgono attorno al danno in un modello murino di SM e nel tessuto umano affetto da SM.
Sviluppo di un farmaco pronto per la clinica
Un team di chimici farmaceutici del Contineum, guidato dal Dottor Austin Chen, si è quindi messo al lavoro sul farmaco concepito da Chan e Green, progettando PIPE-307 per bloccare in modo potente M1R e penetrare nel cervello.
I ricercatori hanno testato gli effetti del nuovo farmaco su OPC coltivate in piastre di Petri e modelli animali di SM utilizzando i metodi di Chan e Green per tracciare la rimielinizzazione. PIPE-307 ha bloccato il recettore M1R molto meglio della clemastina; ha spinto le OPC a maturare in oligodendrociti e iniziare a mielinizzare gli assoni vicini e ha attraversato la barriera ematoencefalica.
Ma la cosa più significativa è che ha invertito la degradazione osservata in un modello murino di SM.
“Un farmaco potrebbe sembrare efficace in questi scenari astratti, agendo sul recettore o sulla cellula giusta, ma la scoperta fondamentale è stato l’effettivo recupero della funzionalità del sistema nervoso“, ha affermato Chan.
Nel 2021, PIPE-307 ha superato uno studio clinico di Fase I, dimostrando la sua sicurezza. Attualmente è in fase di sperimentazione su pazienti con SM in Fase II.
Se avrà successo, potrebbe trasformare il modo in cui viene curata la SM.
Leggi anche:Sclerosi multipla: scoperto nuovo obiettivo terapeutico
“Ogni paziente a cui viene diagnosticata la SM arriva con un certo grado di lesione preesistente“, ha detto Green. “Ora potremmo avere la possibilità non solo di fermare la loro malattia, ma anche di guarirla“.