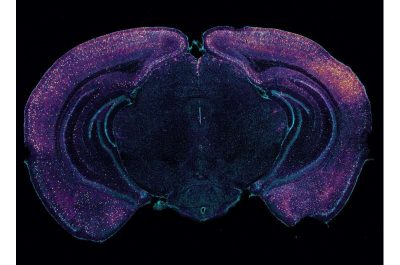
Alzheimer-Immagine: la colorazione brillante evidenzia gli interneuroni che esprimono VIP in questa sezione trasversale coronale di un cervello di topo. I neuroni possono aiutare a guidare la clearance glinfatica dell’amiloide attraverso il rilascio di peptidi. Credito: Laboratorio Tsai/MIT Picower Institute.
Studi al MIT e altrove stanno producendo prove crescenti che lo sfarfallio della luce e il clic del suono alla frequenza del ritmo cerebrale gamma di 40 Hz possono ridurre la progressione della malattia di Alzheimer (AD) e trattare i sintomi nei volontari umani e nei topi di laboratorio.
In un nuovo studio pubblicato su Nature, utilizzando un modello murino della malattia, i ricercatori del Picower Institute for Learning and Memory del MIT rivelano un meccanismo chiave che può contribuire a questi effetti benefici: l’eliminazione delle proteine amiloidi, un segno distintivo della patologia dell’AD, attraverso il il sistema glinfatico del cervello, una rete “idraulica” scoperta di recente parallela ai vasi sanguigni del cervello.
“Da quando abbiamo pubblicato i nostri primi risultati nel 2016, le persone mi hanno chiesto come funziona questo trattamento? Perché 40 Hz? Perché non un’altra frequenza?“ ha detto l’autore senior dello studio Li-Huei Tsai, Professore di neuroscienze a Picower e Direttore del Picower Institute e della Aging Brain Initiative del MIT. “Queste sono davvero domande molto importanti per le quali abbiamo lavorato molto duramente in laboratorio“.
Il nuovo articolo descrive una serie di esperimenti, condotti da Mitch Murdock quando era dottorando in Scienze cognitive e cerebrali al MIT, dimostrando che quando la stimolazione gamma sensoriale aumenta la potenza e la sincronia a 40 Hz nel cervello dei topi, ciò induce un particolare tipo di neurone a rilasciare peptidi.
I risultati dello studio suggeriscono inoltre che quei brevi segnali proteici guidano poi processi specifici che promuovono una maggiore eliminazione dell’amiloide attraverso il sistema glinfatico.
“Non abbiamo ancora una mappa lineare dell’esatta sequenza degli eventi che si verificano“, ha detto Murdock, che è stato supervisionato congiuntamente da Tsai e dal coautore e collaboratore Ed Boyden, Y. Eva Tan, Professore di Neurotecnologia al MIT, membro del il McGovern Institute for Brain Research e membro affiliato del Picower Institute. “Ma i risultati dei nostri esperimenti supportano questo percorso di eliminazione attraverso le principali vie glinfatiche“.
Dai gamma ai glinfatici
Poiché ricerche precedenti avevano dimostrato che il sistema glinfatico è un condotto chiave per l’eliminazione dei rifiuti cerebrali e può essere regolato dai ritmi cerebrali, il team di Tsai e Murdock ha ipotizzato che potrebbe aiutare a spiegare le precedenti osservazioni del laboratorio secondo cui la stimolazione sensoriale gamma riduce i livelli di amiloide nei topi modello di Alzheimer.
Lavorando con topi “5XFAD”, che modellano geneticamente l’Alzheimer, Murdock e coautori hanno prima replicato i risultati precedenti del laboratorio secondo cui la stimolazione sensoriale a 40 Hz aumenta l’attività neuronale a 40 Hz nel cervello e riduce i livelli di amiloide. Quindi hanno iniziato a misurare se ci fosse qualche cambiamento correlato nei fluidi che scorrono attraverso il sistema glinfatico per portare via i rifiuti.
Infatti, hanno misurato gli aumenti del liquido cerebrospinale nel tessuto cerebrale dei topi trattati con stimolazione gamma sensoriale rispetto ai controlli non trattati. Hanno anche misurato un aumento della velocità del liquido interstiziale che lascia il cervello.
Inoltre, nei topi trattati con raggi gamma i ricercatori hanno misurato l’aumento del diametro dei vasi linfatici che drenano i liquidi e hanno misurato un aumento dell’accumulo di amiloide nei linfonodi cervicali che è il sito di drenaggio di quel flusso.
Per studiare come potrebbe verificarsi questo aumento del flusso di fluido, il team si è concentrato sul canale dell’acqua dell’acquaporina 4 (AQP4) delle cellule degli astrociti, che consente alle cellule di facilitare lo scambio di fluidi glinfatici.
Quando hanno bloccato la funzione APQ4 con una sostanza chimica, ciò ha impedito alla stimolazione gamma sensoriale di ridurre i livelli di amiloide e di migliorare l’apprendimento e la memoria dei topi. E quando, come test aggiuntivo, hanno utilizzato una tecnica genetica per interrompere l’AQP4, che ha interferito anche con la clearance dell’amiloide determinata dai raggi gamma.
Oltre allo scambio di fluidi promosso dall’attività APQ4 negli astrociti, un altro meccanismo mediante il quale le onde gamma promuovono il flusso glinfatico è l’aumento della pulsazione dei vasi sanguigni vicini. Diverse misurazioni hanno mostrato una pulsatilità arteriosa più forte nei topi sottoposti a stimolazione gamma sensoriale rispetto ai controlli non trattati.
Una delle migliori nuove tecniche per monitorare il modo in cui una condizione, come la stimolazione gamma sensoriale, influenza diversi tipi di cellule è sequenziare il loro RNA per tenere traccia dei cambiamenti nel modo in cui esprimono i loro geni. Usando questo metodo, il team di Tsai e Murdock ha visto che la stimolazione sensoriale gamma promuoveva effettivamente cambiamenti coerenti con l’aumento dell’attività AQP4 degli astrociti.
Spinto dai peptidi
I dati di sequenziamento dell’RNA hanno anche rivelato che dopo la stimolazione sensoriale gamma un sottoinsieme di neuroni, chiamati “interneuroni”, ha sperimentato un notevole aumento nella produzione di diversi peptidi. Ciò non sorprende, nel senso che è noto che il rilascio del peptide dipende dalle frequenze del ritmo cerebrale, ma è comunque degno di nota perché un peptide in particolare, VIP, è associato ai benefici nella lotta all’Alzheimer e aiuta a regolare le cellule vascolari, il flusso sanguigno e clearance glinfatica.
Approfittando di questo risultato intrigante, il team ha eseguito test che hanno rivelato un aumento del VIP nel cervello dei topi trattati con raggi gamma. I ricercatori hanno anche utilizzato un sensore di rilascio di peptidi e hanno osservato che la stimolazione gamma sensoriale determinava un aumento del rilascio di peptidi dagli interneuroni che esprimono VIP.
Ma questo rilascio di peptidi stimolato dai raggi gamma ha mediato la clearance glinfatica dell’amiloide? Per scoprirlo, il team ha eseguito un altro esperimento: ha spento chimicamente i neuroni VIP. Quando lo hanno fatto, e poi hanno esposto i topi alla stimolazione gamma sensoriale, hanno scoperto che non c’era più un aumento della pulsatilità arteriosa e non c’era più la clearance dell’amiloide stimolata dai raggi gamma.
“Pensiamo che siano coinvolti molti neuropeptidi“, ha detto Murdock. Tsai ha aggiunto che una nuova importante direzione per la ricerca del laboratorio sarà quella di determinare quali altri peptidi o altri fattori molecolari potrebbero essere guidati dalla stimolazione gamma sensoriale.
Leggi anche:L arma segreta dell olio d oliva contro l Alzheimer: i composti fenolici
Tsai e Murdock hanno aggiunto che, sebbene questo articolo si concentri su quello che è probabilmente un meccanismo importante – la rimozione glinfatica dell’amiloide – attraverso la quale la stimolazione gamma sensoriale aiuta il cervello, probabilmente non è l’unico meccanismo sottostante che conta. Gli effetti di eliminazione mostrati in questo studio si sono verificati piuttosto rapidamente, ma negli esperimenti di laboratorio e negli studi clinici sono state necessarie settimane o mesi di stimolazione gamma sensoriale cronica per avere effetti sostenuti sulla cognizione.
Con ogni nuovo studio, tuttavia, gli scienziati apprendono di più su come la stimolazione sensoriale dei ritmi cerebrali possa aiutare a trattare i disturbi neurologici.