I sintomi comuni dell’infiammazione del fegato causata dal virus dell’epatite E (HEV) comprendono febbre, dolore addominale, nausea e ittero. Gli individui a rischio per questa infezione includono persone con un sistema immunitario indebolito (immunocompromessi) e donne incinte. I pazienti immunocompromessi spesso soffrono di infezioni croniche, il che rappresenta un problema.
Le donne incinte soffrono spesso di casi gravi (epatite fulminante). Questo tipo di epatite è associato a tassi di mortalità fino al 30% e si verifica principalmente nel Sud del mondo. Le differenze geografiche possono essere spiegate dal fatto che i ceppi zoonotici di HEV di origine alimentare (genotipi 3 e 4) circolano prevalentemente al nord, mentre i genotipi 1 e 2, prevalentemente di origine idrica, sono presenti nel sud.
Finora in Europa non è stato autorizzato alcun vaccino contro l’HEV. Sebbene esistano medicinali utilizzati per trattare le infezioni, le opzioni terapeutiche sono ancora limitate e associate a forti effetti collaterali o allo sviluppo di resistenza. Ciò è dovuto anche alla mancata comprensione di gran parte del ciclo di vita virale.
Poliproteina virale pORF1: centrale nella produzione del genoma virale e tuttavia quasi sconosciuta
La riproduzione dell’informazione genetica dell’HEV (replicazione del genoma) è mediata dalla poliproteina virale pORF1. Questa proteina è costituita da più domini. Un dominio proteico è una struttura ripiegata stabilmente all’interno di una proteina che è funzionalmente e strutturalmente indipendente dai segmenti proteici adiacenti.
pORF1 è la proteina centrale per la replicazione (replicasi), ovvero è responsabile della riproduzione dell’informazione genetica del virus. Tuttavia, si sa poco altro su pORF1, inclusa la sua esatta posizione all’interno delle cellule infette.
I ricercatori guidati dal Dott. Sottor Mirco Glitscher nel gruppo di lavoro del Professor Eberhard Hildt, capo della divisione di virologia del Paul-Ehrlich-Institut, si sono concentrati su questo importante elemento sconosciuto dell’HEV. Nella loro ricerca, hanno utilizzato la microscopia confocale a scansione laser per analizzare la localizzazione subcellulare di pORF1 e i suoi singoli domini, che sono stati generati e clonati sulla base di una previsione strutturale della replicasi virale.
Gli esosomi rilasciati dalle cellule sono stati isolati mediante ultracentrifugazione e analizzati mediante centrifugazione in gradiente di densità isopicnica (separazione secondo la stessa densità). Le particelle separate sono state quindi esaminate più da vicino mediante fluorimetria, analisi Western blot o RT-qPCR.
Il sistema vescicolare cardine della riproduzione del virus
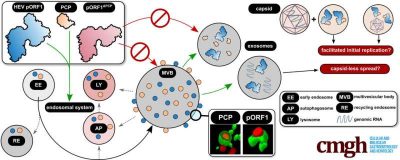
Il gruppo di ricerca ha scoperto che pORF1 si accumula nel sistema vescicolare della cellula, il sistema endosomiale, e principalmente nei corpi multivescicolari (MVB). Queste strutture sono fondamentali per la formazione degli esosomi e finora sono state considerate solo come una struttura ospite per il rilascio di particelle virali HEV. La presenza della replicasi virale qui è stata identificata come dipendente da un dominio pORF1, il PCP (proteasi cisteina simile alla papaina).
Il gruppo di ricerca ha così scoperto che la replicasi virale viene rilasciata anche attraverso gli esosomi. Questo processo è mediato dalla proteasi virale che fa parte della replicasi. Di conseguenza, i genomi virali vengono rilasciati attraverso questa via anche in assenza di particelle virali.
I risultati indicano che pORF1 entra negli MVB in modo PCP-dipendente, seguito dal rilascio esosomale. Pertanto il rilascio del virus e la replicazione, la riproduzione dell’informazione genetica, possono essere accoppiati spazialmente. Ciò potrebbe facilitare la diffusione dell’infezione virale, poiché i genomi che entrano nella cellula durante la reinfezione possono rapidamente incontrare pORF1 trasmesso dall’esosoma ed essere replicati. Inoltre, i dati raccolti indicano che il capside non è “necessariamente” necessario per il rilascio di materiale genetico.
Gli esosomi e le strutture proteiche associate potrebbero essere bersagli adatti per terapie contro l’HEV, perché ciò potrebbe impedire sia la replicazione virale che il rilascio virale. Il rilascio indipendente dal capside dei genomi HEV ha sicuramente un impatto sulla diagnostica, poiché finora si presumeva che esistesse una correlazione tra la quantità di particelle virali e i genomi virali.
Leggi anche:Virus dell’epatite E: preziose informazioni sulla sua evoluzione
Tuttavia, la rilevanza della presenza di RNA genomico negli esosomi senza capside quando si tratta di procedure diagnostiche deve ancora essere studiata.
La ricerca è stata pubblicata sulla rivista Cellular and Molecular Gastroenterology and Hepatology.
Immagine: astratto grafico Graphical Abstract. Credit: Cellular and Molecular Gastroenterology and Hepatology (2024).
Fonte: Cellular and Molecular Gastroenterology and Hepatology