Malattia dei motoneuroni. Immagine: astratto grafico. Credito: Neurone (2024)-
I neuroscienziati della Macquarie University hanno sviluppato un farmaco genetico monodose che ha dimostrato di arrestare la progressione sia della malattia dei motoneuroni (MND) che della demenza frontotemporale (FTD) nei topi e che potrebbe persino offrire il potenziale per invertire alcuni degli effetti della malattia.
Potrebbe anche offrire opportunità per il trattamento di forme più comuni di demenza, come il morbo di Alzheimer, che è la seconda causa di morte più comune in Australia, dopo le malattie cardiache.
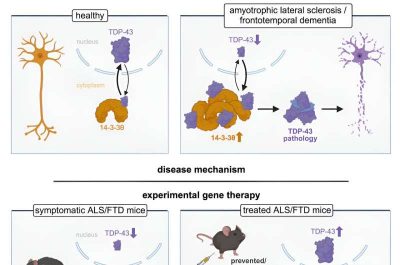
Il nuovo trattamento, CTx1000, mira agli accumuli patologici della proteina TDP-43 nelle cellule del cervello e del midollo spinale.
Cellule come i neuroni producono naturalmente TDP-43 ed è importante per la loro sana funzione. In determinate condizioni, TDP-43 si accumula nella parte sbagliata delle cellule, intasandole e impedendone il corretto funzionamento.
Negli ultimi 15 anni, un gruppo di ricerca della Macquarie University guidato dal Professor Lars Ittner ha cercato le cause di questo accumulo patologico di TDP-43, insieme ai modi per eliminare i blocchi e prevenirne la formazione.
Le ultime scoperte del team sono state pubblicate da Neuron.
Il Professor Ittner afferma che la loro ricerca ha migliorato la loro comprensione della MND e della FTD e delle loro cause.
“Abbiamo scoperto per la prima volta che dove è presente la TDP-43 patologica, c’è anche un aumento di una seconda proteina, la 14‑3‑3“, afferma. “Le due proteine interagiscono, provocando questi accumuli nelle cellule.
“Da questo, siamo stati in grado di isolare un breve peptide che controlla questa interazione, ed è quello che abbiamo usato per creare CTx1000. Quando l’abbiamo somministrato in laboratorio, ha sciolto gli accumuli, contrassegnando le proteine TDP-43 per il riciclo da parte dell’organismo e ha impedito la formazione di nuove. È importante sottolineare che CTx1000 prende di mira solo TDP-43 patologica, consentendo alla versione sana delle proteine di svolgere il loro lavoro senza ostacoli“.
Ciò rende CTx1000 incredibilmente sicuro e il Professor Ittner afferma di non aver riscontrato effetti avversi nello studio.

La Prof.ssa Yazi Ke, autrice principale del nuovo articolo, afferma che questo traguardo è particolarmente emozionante per lei perché la scoperta originale è stata fatta nei suoi primi giorni post-dottorato.
“Questo studio abbraccia più di un decennio di lavoro e va dalla scoperta fino a un potenziale trattamento“, afferma. “In condizioni di laboratorio, abbiamo visto CTx1000 fermare la progressione della MND e della FTD anche a stadi molto avanzati e risolvere i sintomi comportamentali associati alla FTD. Abbiamo grandi speranze che, quando si passerà alla sperimentazione umana, non solo si impedirà alle persone di morire sia di MND che di FTD, ma permetterà anche ai pazienti di riacquistare parte della funzione perduta attraverso la riabilitazione“.
La Dr.ssa Annika van Hummel, ricercatrice, afferma che durante i test di laboratorio hanno scoperto una varietà di mutazioni nei geni TDP.
“Volevamo dimostrare oltre ogni dubbio che CTx1000 avrebbe funzionato in diverse situazioni e avrebbe portato a chiari miglioramenti sia nei sintomi che nella patologia cerebrale“, dice. “Il fatto che sia stato efficace sia prima che dopo la comparsa dei sintomi lo rende particolarmente emozionante. Anche se inizialmente ci concentreremo su MND e FTD, circa il 50% dei casi di Alzheimer mostra anche la patologia TDP, quindi è possibile che in futuro questo trattamento possa essere traducibile ad altre condizioni neurodegenerative“.
Un disperato bisogno di opzioni terapeutiche
Conosciuta anche come sclerosi laterale amiotrofica (SLA), la MND provoca la progressiva perdita dei neuroni che consentono al cervello e alla colonna vertebrale di comunicare con i muscoli.
Nelle fasi iniziali, i pazienti sperimentano debolezza muscolare, ma con il progredire della malattia perdono gradualmente la capacità di camminare, parlare, deglutire e respirare senza aiuto. La maggior parte delle persone affette da MND muore entro due o cinque anni dalla diagnosi.
La FTD è una delle forme più rare di demenza, ma è la seconda forma più comune nelle persone di età inferiore ai 65 anni. All’attore Bruce Willis è stata diagnosticata la FTD nel 2023.
Non sempre presenta sintomi fisici evidenti, ma provoca un declino cognitivo abbinato a sintomi comportamentali tra cui ansia, perdita di inibizione, cambiamento di personalità e compromissione della capacità di giudizio. I pazienti possono vivere per più di 10 anni dopo la diagnosi, ma alla fine è fatale.
Sebbene esista una terapia genetica promettente per una forma di MND familiare, sono pochi i trattamenti disponibili per la MND sporadica che costituisce il 90% di tutti i casi.
Di questi, il più efficace può prolungare la vita del paziente solo fino a cinque mesi. Tutti richiedono dosi frequenti e alcuni presentano effetti collaterali difficili da affrontare.
Attualmente non esiste alcun trattamento per la FTD.
Il Professore di neurologia della Macquarie University, il professor Dominic Rowe, è uno dei principali medici e ricercatori australiani sulla MND. “Attualmente sto curando più di 200 persone affette da MND, ma solo cinque di loro con un tipo specifico di MND familiare sono attualmente in grado di accedere alla terapia genetica“, afferma la Prof.ssa Rowe.
“Un trattamento del genere non esiste per nessun altro. Per la maggior parte dei pazienti, tutto ciò che possiamo fare è fornire cure multidisciplinari di buona qualità. Questa nuova ricerca è incredibilmente promettente nel rallentare la progressione della SLA e della FTD per la stragrande maggioranza dei nostri pazienti. Sono estremamente fiducioso che sarà presto disponibile per i nostri pazienti presso la Clinica MND del Macquarie University Hospital“, aggiunge.
Gli alti costi della ricerca
Il Professor Ittner e il Professor Ke sperano di poter iniziare la sperimentazione sull’uomo del CTx1000 entro due anni e hanno già ricevuto una sovvenzione preclinica di 1,2 milioni di dollari.
La terapia è una delle scoperte chiave sostenute da Celosia Therapeutics, una società spin-out della Macquarie University fondata nel 2022 per contribuire a portare il lavoro innovativo dei neuroscienziati dell’Università dal laboratorio ai pazienti.
Sfortunatamente, testare nuove terapie e portarle ai pazienti in attesa è incredibilmente costoso: in questo caso, il costo stimato è di 22 milioni di dollari per arrivare alla sperimentazione umana.
L’amministratore delegato di Celosia, il Dottor Brenton Hamdorf, è attivamente alla ricerca di investimenti per facilitare il passaggio di CTx1000 alla fase di sperimentazione clinica.
“C’è un disperato bisogno di nuovi farmaci per le malattie neurodegenerative come la MND e questa è una nuova entusiasmante terapia con un potenziale enorme“, afferma il Dottor Hamdorf.
Leggi anche:Malattia dei motoneuroni: passo avanti nei trattamenti
“La MND è difficile da diagnosticare perché non esiste un test conclusivo. È un processo di eliminazione che può richiedere fino a 12 o 18 mesi, entro i quali la malattia è progredita in modo significativo. Abbiamo il potenziale affinché CTx1000 diventi un trattamento one-shot in grado di aiutare le persone anche nelle fasi avanzate della malattia, quindi sarebbe letteralmente una luce alla fine del tunnel che i pazienti e le loro famiglie semplicemente non hanno ora“, ha aggiunto.
Fonte:Neuron