Alzheimer.Immagine: aggregati di proteine tau.
Un nuovo studio pubblicato su Nature Communications fornisce informazioni sui meccanismi alla base della formazione di grumi proteici nella malattia di Alzheimer. Lo studio, condotto da ricercatori del Karolinska Institutet, potrebbe aprire la strada a nuovi trattamenti per questa devastante malattia neurodegenerativa.
La malattia di Alzheimer colpisce milioni di persone in tutto il mondo, causando perdita di memoria, confusione e declino cognitivo. Una delle caratteristiche principali della malattia è l’accumulo di grumi proteici anomali, chiamati fibrille e placche amiloidi, nel cervello. Questi grumi interferiscono con il normale funzionamento delle cellule cerebrali e possono innescare infiammazioni e morte cellulare.
Gli scienziati stanno cercando di capire come si formano queste fibrille e come prevenirne la formazione. Una strategia consiste nell’utilizzare proteine che possano legarsi a siti specifici sulla superficie delle fibrille e bloccare la generazione di nuovi aggregati. Queste proteine sono chiamate chaperoni molecolari e sono prodotte naturalmente dalle cellule per aiutare altre proteine a ripiegarsi e a funzionare correttamente.
“Nel nostro studio abbiamo utilizzato uno chaperone molecolare specifico, chiamato BRICHOS“, afferma Axel Abelein, ultimo autore dello studio. “È stato dimostrato in precedenza che BRICHOS inibisce la formazione di fibrille amiloidi. Ora volevamo scoprire come riconosce e si lega alla superficie delle fibrille, dandoci indizi su quali parti delle fibrille vengono prodotti i nuovi aggregati“.
Target degli hotspot
I ricercatori del Laboratorio per il misfolding e l’assemblaggio delle proteine, Dipartimento di Bioscienze e Nutrizione, Karolinska Institutet, hanno utilizzato tecniche avanzate di biologia strutturale, come la risonanza magnetica nucleare allo stato solido (NMR) e la microscopia elettronica, per visualizzare la struttura e le interazioni di BRICHOS e le fibrille a livello atomico.
Hanno scoperto che BRICHOS può percepire e attaccarsi a regioni specifiche sulle fibrille, che possono fungere da punti caldi di aggregazione. Legandosi a questi punti caldi, BRICHOS può probabilmente prevenire l’ulteriore generazione di aggregati e quindi sopprimere i loro effetti tossici.
Leggi anche:Alzheimer: infezione da H. pylori aumenta il rischio
I ricercatori suggeriscono che prendere di mira questi punti caldi di aggregazione potrebbe essere un modo promettente per interferire con il processo di formazione delle fibrille e i suoi effetti dannosi nella malattia di Alzheimer. Si prevede inoltre di indagare se meccanismi simili siano coinvolti in altri disturbi neurodegenerativi, come il morbo di Parkinson, anch’essi caratterizzati dall’aggregazione proteica.
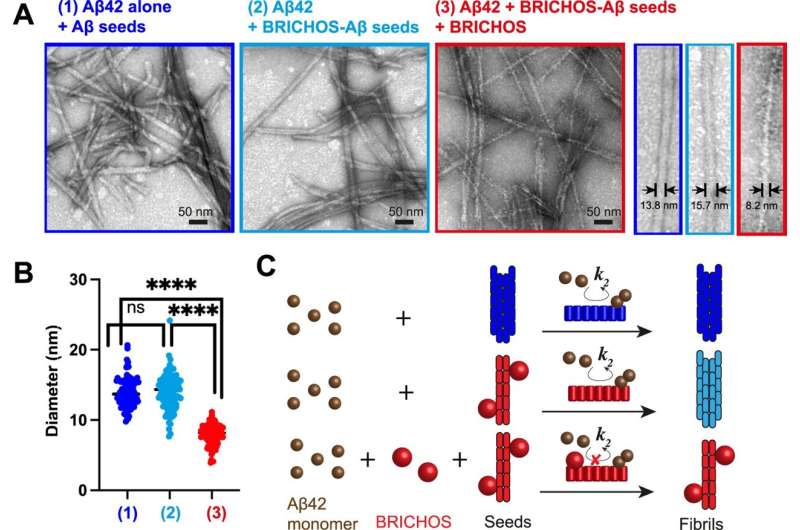
Immagine:astratto grafico. Morfologia delle fibrille seminate di terza generazione. Credito: Nature Communications.
Questo studio è stato condotto in collaborazione con gruppi di Lione, Francia e Riga, Lettonia, che hanno fornito accesso e competenze alla nuova strumentazione NMR a stato solido.