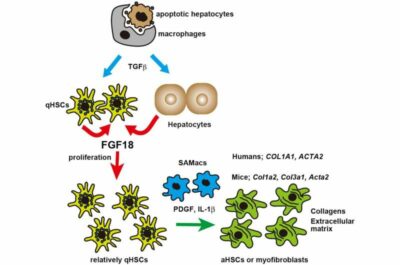
Fibrosi epatica-Immagine: in risposta a varie lesioni, il TGFb o fattore di crescita trasformante beta viene rilasciato da diversi tipi di cellule, come i macrofagi che inglobano gli epatociti apoptotici. Quindi, TGFb induce la produzione di FGF18 o fattore di crescita dei fibroblasti 18 nelle HSC e negli epatociti. FGF18 stimola quindi la proliferazione delle HSC o cellule stellate epatiche. Le HSC proliferanti rispondono ulteriormente agli stimoli derivati dai macrofagi associati alla cicatrice e producono collagene e matrice extracellulare, promuovendo così la fibrosi epatica. Credito: Hiroyasu Nakano-
La fibrosi epatica è associata a varie lesioni epatiche, infezioni virali, infiammazioni, consumo eccessivo di alcol e disfunzione metabolica. Ancora più importante, il numero di pazienti con steatoepatite associata a disfunzione metabolica (MASH) è in aumento in tutto il mondo.
La fibrosi è un determinante critico della prognosi dei pazienti con malattie epatiche, ma attualmente non ci sono farmaci antifibrotici approvati per il trattamento della fibrosi epatica. Pertanto, per soddisfare le esigenze mediche insoddisfatte della fibrosi epatica è necessario chiarire i meccanismi molecolari e identificare bersagli farmacologici.
Spiegano gli autori:
“I recenti progressi nella tecnologia di sequenziamento dell’RNA a singola cellula (scRNA-seq) hanno rivelato che le interazioni cellula-cellula svolgono un ruolo cruciale nello sviluppo della fibrosi epatica. Tra le varie cellule coinvolte nella fibrosi epatica, le cellule stellate epatiche (HSC) svolgono un ruolo centrale nel promuovere la fibrosi epatica. In condizioni fisiologiche, le HSC quiescenti si localizzano principalmente nello spazio di Disse e contengono grandi quantità di vitamina A, contribuendo così all’omeostasi della vitamina A. Le HSC quiescenti hanno goccioline lipidiche contenenti retinolo ed esprimono i caratteristici geni marcatori, la lecitina retinolo aciltransferasi (Lrat ) e desmin ( Des). In risposta al danno epatico, le HSC si attivano e le HSC attivate possono perdere l’espressione di Lrat, ma evolversi in miofibroblasti che esprimono α-SMA che esprimono altamente geni profibrotici. È stato dimostrato che varie citochine attivano le HSC; ad esempio, Hedgehog, il fattore di crescita del tessuto connettivo (CTGF) e il fattore di crescita trasformante beta (TGFβ) attivano le HSC. Tuttavia, non è chiaro quali fattori di crescita controllino il numero di HSC e miofibroblasti quiescenti e attivati durante lo sviluppo della fibrosi. Questo è cio’ che abbiamo cercato di chiarire nello studio”.
Le cellule stellate epatiche (HSC), che sono cellule residenti nel fegato, immagazzinano vitamina A e sono quiescenti in condizioni normali. Una volta attivate in risposta al danno epatico, le HSC si differenziano in miofibroblasti e producono collagene e proteine della matrice extracellulare, con conseguente rimodellamento dei tessuti e fibrosi. Pertanto, le molecole che controllano la proliferazione e/o l’attivazione delle HSC rappresentano bersagli terapeutici attraenti.
In un nuovo studio pubblicato su Nature Communications, un gruppo di ricerca giapponese ha riferito che il fattore di crescita dei fibroblasti 18 (FGF18) è un induttore chiave della proliferazione delle HSC e della fibrosi epatica. Utilizzando vari topi knockout del gene condizionale e modelli sperimentali di danno epatico, il team ha identificato FGF18 come un fattore di crescita specificamente sovraregolato nel fegato fibrotico. In condizioni normali, gli epatociti e le HSC esprimevano molto debolmente FGF18, ma FGF18 era drammaticamente elevato in condizioni fibrotiche.
La delezione specifica degli epatociti di Fgf18 ha migliorato la fibrosi epatica in condizioni patologiche e la sovraespressione specifica degli epatociti di Fgf18 ha indotto la fibrosi epatica. Il sequenziamento dell’RNA a cellula singola ha rivelato che il numero di HSC era aumentato nel fegato dei topi che sovraesprimevano Fgf18 negli epatociti.
Inoltre, esperimenti in vitro hanno dimostrato che FGF18 stimola la proliferazione delle HSC senza sovraregolare l’espressione dei geni profibrotici, come i collageni o Acta2. Se combinato con altri fattori che attivano le HSC e inducono l’espressione genica profibrotica, FGF18 promuove la fibrosi epatica attraverso la proliferazione delle HSC. “I nostri risultati indicano che l’FGF18 può essere un bersaglio terapeutico per trattare e prevenire la fibrosi epatica nell’uomo”, ha affermato il Professor Hiroyasu Nakano, autore corrispondente di questo studio presso la Facoltà di Medicina dell’Università di Toho.
In vari modelli animali sperimentali di fibrosi epatica è necessaria la preventiva induzione dell’infiammazione epatica. Dal punto di vista dello screening farmacologico, in questi casi è difficile determinare se il farmaco influisce sull’infiammazione o sui processi fibrotici. Al contrario, i topi epatociti-specifici che sovraesprimono FGF18 utilizzati in questo studio hanno mostrato fibrosi epatica senza precedente induzione di infiammazione epatica.
Leggi anche:Fibrosi epatica: scoperto meccanismo compensatorio precedentemente sconosciuto
“I nostri topi possono essere un nuovo modello animale per affrontare direttamente il processo fibrotico per lo screening dei farmaci antifibrotici nel fegato”, ha affermato il Dottor Yuichi Tsuchiya, il primo autore di questo studio presso la Facoltà di Scienze Farmaceutiche dell’Università di Toho.
Fonte: Nature Communications