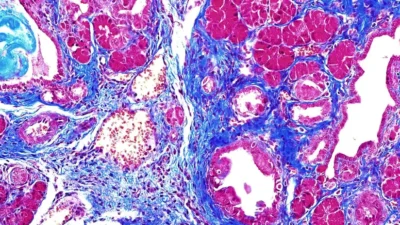
Cancro al pancreas-Immagine: cellule di pancreas di topo con alti livelli della proteina SRSF1; Il Professor Adrian Krainer del CSHL ha scoperto che i topi con alti livelli di SRFS1 tendono a mostrare neoplasia intraepiteliale, un noto precursore della forma più comune di cancro al pancreas. Crediti: Krainer lab/Cold Spring Harbor Laboratory-
I ricercatori del Cold Spring Harbor Laboratory hanno scoperto che la proteina SRSF1, che regola lo splicing dell’RNA, svolge un ruolo fondamentale nello sviluppo dell’adenocarcinoma duttale pancreatico (PDAC), una forma mortale di cancro al pancreas. Livelli elevati di SRSF1 portano all’infiammazione e stimolano la crescita del tumore, mentre il ripristino di livelli normali arresta il progresso della malattia. Questa scoperta potrebbe aprire la strada a nuovi metodi diagnostici e trattamenti per il PDAC.
L’adenocarcinoma duttale pancreatico (PDAC) è la forma più comune di cancro al pancreas. È anche uno dei più letali. Più del 90% dei pazienti con PDAC muore entro cinque anni dalla diagnosi. Di solito, quando il cancro viene identificato, si è già diffuso.
Il PDAC si scopre spesso troppo tardi perché trattamenti come la chemioterapia e la chirurgia siano molto efficaci”, afferma il Professor Adrian Krainer del Cold Spring Harbor Laboratory (CSHL). “Comprendere chiaramente i meccanismi genetici alla base del PDAC, ciò potrebbe portare a diagnosi precoci e nuovi tipi di terapie“.
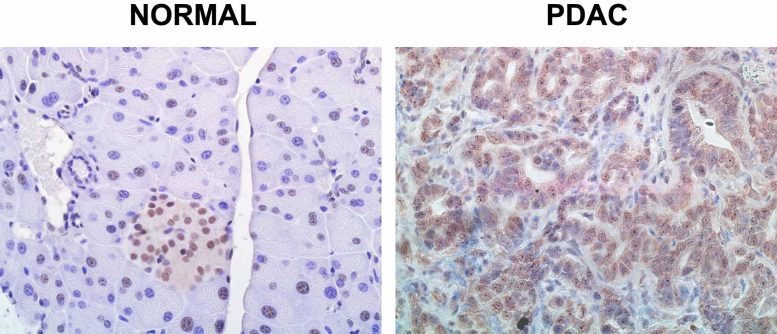
Le normali cellule pancreatiche sane mantengono un livello costante di SRSF1 (colorato in rosso), ma nel PDAC questi livelli crescono senza controllo. Crediti: Krainer lab/Cold Spring Harbor Laboratory
“Le cellule hanno diversi processi per mantenere costanti i livelli di SRSF1“, afferma Krainer. “Ma il cancro tende a trovare un modo per superare questi controlli ed equilibri”.
Diversi geni, RNA e proteine lavorano insieme nelle cellule per mantenere costanti i livelli di SRSF1. Ma a volte, il processo viene interrotto. Nel pancreas, questo innesca la pancreatite e accelera il cancro del pancreas PDAC.
“È un effetto molto pronunciato”, spiega Krainer. “Abbiamo potuto vedere che i pazienti i cui tumori esprimono livelli più elevati di SRSF1 hanno esiti peggiori. Quindi, abbiamo deciso di esplorare fino a che punto SRSF1 contribuisce al PDAC.
Il team ha scoperto che livelli più elevati di SRSF1 sono essenziali per la crescita del PDAC nei topi e negli organoidi, piccole versioni dei tumori. Inoltre, quando SRSF1 è tornato a livelli normali, gli organoidi hanno smesso di crescere. “SRSF1 è importante nei tessuti sani, quindi potrebbe non essere un bersaglio farmacologico ideale da solo. Tuttavia, alcuni dei cambiamenti di giunzione che promuove potrebbero invece essere presi di mira”, dice Krainer, che aggiunge che c’è ancora molto lavoro da fare.
“Siamo entusiasti di questi sviluppi”, afferma il ricercatore, “Ma il PDAC è un tumore maligno difficile e complicato. Speriamo di fornire informazioni utili per trattamenti futuri. Questo lavoro guidato da Ledong è solo la punta dell’iceberg”.
Vedi anche:Cancro al pancreas: come la plasticità guida il cancro
Spiegano gli autori:
“L‘infiammazione è fortemente associata all’adenocarcinoma duttale pancreatico (PDAC), un tumore maligno altamente letale. I fattori di splicing dell’RNA disregolati sono stati ampiamente riportati nella tumorigenesi, ma il loro coinvolgimento nella pancreatite e nel PDAC non è ben compreso. Qui, riportiamo che il fattore di splicing SRSF1 è altamente espresso nella pancreatite, nelle lesioni precursori del PDAC e nei tumori. L’aumento di SRSF1 è sufficiente per indurre pancreatite e accelerare il PDAC mediato da KRASG12D. Meccanicamente, SRSF1 attiva la segnalazione MAPK, in parte sovraregolando il recettore dell’interleuchina 1 di tipo 1 (IL1R1) attraverso la stabilità dell’mRNA regolata dallo splicing alternativo. Inoltre, la proteina SRSF1 è destabilizzata attraverso un meccanismo di feedback negativo nelle cellule epiteliali fenotipicamente normali che esprimono KRASG12D nel pancreas del topo e negli organoidi del pancreas che esprimono acutamente KRASG12D, tamponando la segnalazione MAPK e mantenendo l’omeostasi delle cellule del pancreas. Questa regolazione del feedback negativo di SRSF1 è superata da MYC iperattivo, facilitando la tumorigenesi del PDAC. I nostri risultati implicano SRSF1 nell’eziologia della pancreatite e del PDAC e indicano lo splicing alternativo mal regolato da SRSF1 come potenziale bersaglio terapeutico“.
La collaborazione di Krainer e Wan con il laboratorio di Tuveson fa parte di uno sforzo più ampio per esplorare il pancreas e il cancro al seno. L’iniziativa comprende anche i Professori CSHL David Spector e Christopher Vakoc.
“Il lavoro di cambiamento di paradigma del laboratorio Krainer ha portato a una comprensione più profonda di molti tipi di cancro“, afferma Tuveson, Direttore del CSHL Cancer Center. “La ricerca di Wan rivela una nuova entusiasmante strada per comprendere il cancro al pancreas. Riafferma l’importanza della ricerca biologica di base per il miglioramento della salute umana”.
Fonte: Cancer Discovery