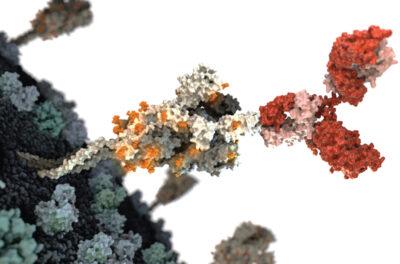
COVID-19-Immagine SARS-CoV-2: un anticorpo (a destra) legato alla proteina spike di superficie di SARS-CoV-2 può bloccare l’infezione. V. ALTOUNIANO/ SCIENZA-
Con il rallentamento della pandemia e la diminuzione dei finanziamenti COVID-19, i ricercatori temono che le aziende non avranno incentivi per portare sul mercato anticorpi migliorati!
Nel 2020, mentre infuriava la pandemia di COVID-19 e farmaci efficaci erano sfuggenti, gli anticorpi monoclonali (mAb) sono emersi come trattamento salvavita. Ma ora, 3 anni dopo, tutte le approvazioni per gli anticorpi contro COVID-19 sono state revocate negli Stati Uniti, poiché le mutazioni del virus SARS-CoV-2 hanno reso inefficaci i farmaci, che prendono di mira parti del virus originale.
I ricercatori di tutto il mondo stanno ora cercando di rilanciare i trattamenti anticorpali riprogettandoli per mirare a bersagli meno inclini alla mutazione. “Esistono nuovi approcci che presentano un compito molto più impegnativo da eludere per il virus“, afferma Paul Bieniasz, virologo della Rockefeller University. Proprio questa settimana, ad esempio, i ricercatori in Canada hanno riferito di aver creato composti simili ad anticorpi in grado di afferrare contemporaneamente dozzine di siti sulle proteine virali, agendo come una sorta di Velcro molecolare per trattenere il virus anche se alcuni dei siti sono mutati per eludere il farmaco candidato. Altri ricercatori hanno adottato approcci meno radicali per produrre anticorpi resistenti alle mutazioni.
Tutti, però, temono che il lavoro possa tardare ad arrivare alla clinica. Con l’emergenza pandemica dichiarata finita negli Stati Uniti e in altri paesi, i Governi e l’Industria potrebbero avere meno incentivi per sviluppare nuovi promettenti trattamenti COVID-19. “Non esiste più un modello di business per questo”, afferma Michael Osterholm, esperto di salute pubblica presso l’Università del Minnesota.
Gli anticorpi che inizialmente hanno salvato vite umane si sono attaccati tutti alla punta della proteina virale Spike, la proteina che SARS-CoV-2 utilizza per legarsi all’enzima di conversione dell’angiotensina 2 (ACE2), un recettore sulla superficie delle cellule umane. Per i primi 2 anni della pandemia, spike è cambiato abbastanza modestamente da consentire agli mAb di continuare a funzionare. Ma poiché il virus ha incontrato più persone con anticorpi di precedenti infezioni e vaccinazioni, sono emerse nuove varianti con ampie mutazioni nella regione di legame ACE2, nota come dominio di legame al recettore (RBD). Le varianti hanno evitato il trattamento e lasciato le aziende farmaceutiche in difficoltà. “Quando hai isolato un buon [mAb] il virus è andato avanti”, afferma Laura Walker, che dirige l’ingegneria bioterapeutica delle malattie infettive per Moderna.
Ora, i ricercatori stanno cercando anticorpi mirati a segmenti della spike che il virus non può mutare senza perdere la sua capacità di infettare le cellule. “Le persone stanno cercando quella gemma nascosta che prende di mira qualcosa di così conservato che il virus non può mutare lontano da esso”, afferma Jean-Philippe Julien, immunologo dell’Università di Toronto.
A marzo, ad esempio, un team internazionale guidato da ricercatori dell’Università della Svizzera italiana ha riferito di aver isolato diversi anticorpi umani mirati a bersagli conservati su spike, invariati in più varianti virali. Uno di questi si lega a un sito noto come peptide di fusione, impedendo al virus di fondersi con le cellule umane. Nei test cellulari, l’anticorpo si è legato a quattro famiglie separate di coronavirus, tra cui SARS-CoV-2. Un altro anticorpo, che prende di mira un sito di spike noto come elica dello stelo, ha impedito a tutte le varianti di SARS-CoV-2 di fondersi con le membrane cellulari umane. Il gruppo, che ha riportato nel numero del 10 marzo di Science Immunology la ricerca, ha anche scoperto che un anticorpo “bispecifico” che si lega sia all’RBD che a una regione separata chiamata sottodominio 1 (SD1) coinvolta nella fusione cellulare proteggeva i topi dalle varianti ancestrali e Omicron SARS-CoV-2.
Altri gruppi stanno perseguendo la stessa strategia. I ricercatori del Fred Hutchinson Cancer Center (FHCC) hanno riferito in una prestampa di marzo su bioRxiv che anche loro hanno isolato un anticorpo mirato all’SD1 che protegge i topi da tutte le recenti varianti di preoccupazione. E a gennaio, un gruppo guidato dal biologo degli anticorpi Joshua Tan presso il National Institute of Allergy and Infectious Diseases ha riferito su Cell Host & Microbe che altri peptidi di fusione e anticorpi che legano l’elica possono neutralizzare un’ampia gamma di varianti di SARS-CoV-2 negli animali . “Ci sono sempre più anticorpi che agiscono in modo più ampio perché prendono di mira la proteina Spike in diverse aree”, afferma Julie Overbaugh, virologa dell’FHCC che ha guidato il lavoro sull’SD1.
Un approccio separato prende di mira la proteina umana, ACE2, a cui SARS-CoV-2 e i suoi parenti si legano sulla superficie cellulare. La scorsa settimana, Bieniasz e i suoi colleghi hanno riportato risultati incoraggianti in Nature Microbiology. Hanno iniettato topi con copie di una versione solubile del recettore umano ACE2. Trentacinque giorni dopo, hanno esaminato il siero del sangue degli animali per gli anticorpi che miravano all’ACE2 e impedivano al SARS-CoV-2 di legarsi ad esso. Hanno selezionato il più potente e lo hanno iniettato nei topi che erano stati infettati da una variante SARS-CoV-2 o da una varietà di altri sarbecovirus, il gruppo di virus umani e animali che include SARS-CoV-2. “L’anticorpo era ugualmente efficace contro tutti loro”, dice Bieniasz.
“Questo sembra abbastanza promettente”, dice Overbaugh. Ma lei e altri temono che prendere di mira le proteine umane possa provocare effetti collaterali. Si preoccupano di interferire con la normale funzione di ACE2, poiché aiuta a regolare la pressione sanguigna tra le altre funzioni. Rapporti recenti hanno aumentato la preoccupazione suggerendo che le persone con Long Covid potrebbero produrre anticorpi contro le proprie proteine, incluso l’ACE2. Bieniasz concorda sul fatto che saranno necessarie ulteriori prove sugli animali e sull’uomo della strategia, ma osserva che negli studi iniziali sulla coltura cellulare, l’anticorpo del suo gruppo non sembra impedire all’ACE2 di funzionare correttamente.
Vedi anche:COVID 19: fine dell’emergenza sanitaria globale
Una terza strategia mira a modificare la struttura degli anticorpi stessi nella speranza di renderli più potenti. Gli anticorpi sono generalmente a forma di Y, con due bracci che possono attaccarsi a due bersagli separati. Julien e i suoi colleghi hanno progettato una famiglia di “multicorpi” sferici, ciascuno con 24 siti di attacco. Nel suo studio più recente, pubblicato questa settimana su Science Translational Medicine, il team di Toronto ha progettato due diversi multicorpi, uno in cui tutti i 24 siti di legame hanno preso di mira lo stesso sito sulla proteina spike di SARS-CoV-2, l’altro che ha preso di mira tre siti diversi. Quando hanno iniettato i loro multibodies nei topi infetti, hanno scoperto che entrambi i modelli neutralizzavano il virus a dosi ben al di sotto di quelle necessarie per gli anticorpi convenzionali. Il multicorpo a tre bersagli ha anche neutralizzato tutte le sottovarianti recenti e un’ampia gamma di virus più lontanamente correlati a SARS-CoV-2.
Walker, che è rimasto impressionato da questi risultati, avverte che poiché la strategia multicorpo è nuova, deve affrontare una strada più lunga per la clinica. I ricercatori devono verificare che i multicorpi rimangano in circolazione per giorni, se non mesi, dopo l’infusione e gli sviluppatori devono dimostrare che i farmaci possono essere prodotti in modo affidabile ed economico. “Non è sufficiente avere mAbs che funzionino, ma è anche importante che siano disponibili”, afferma Osterholm.