Anemia falciforme-Immagine Credit Public Domain.
Ogni giorno, miliardi di globuli rossi passano attraverso la milza, un organo responsabile del filtraggio delle cellule del sangue vecchie o danneggiate. Questo compito è reso più difficile quando le cellule del sangue sono deformate, come nei pazienti con anemia falciforme, che colpisce milioni di persone in tutto il mondo. Le cellule del sangue falciformi possono ostruire i filtri della milza, portando a una situazione potenzialmente pericolosa per la vita.
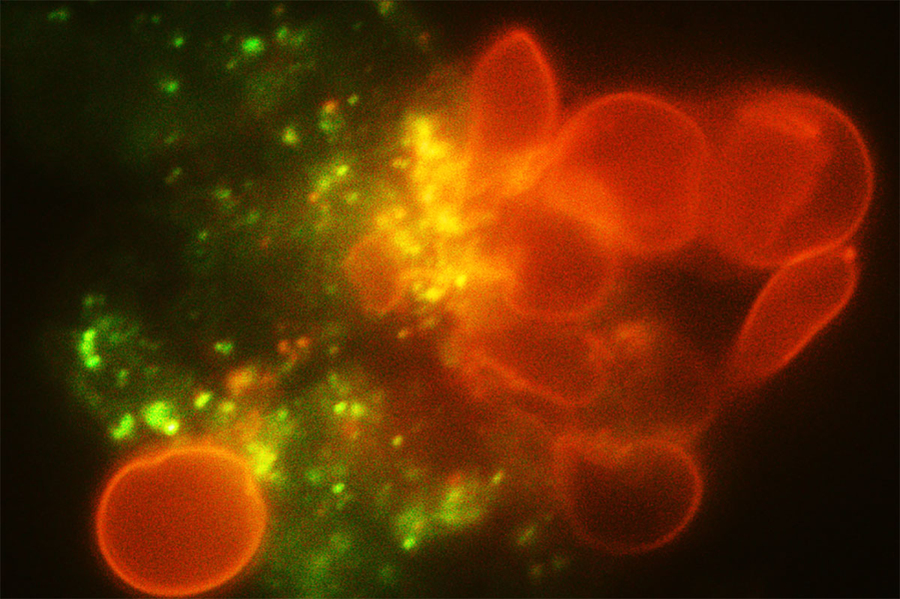
I ricercatori del MIT, della Nanyang Technological University di Singapore, dell’Istituto Pasteur di Parigi e di altre istituzioni hanno ora progettato un dispositivo microfluidico o “milza su chip”, che può modellare come questo fenomeno, noto come sequestro splenico acuto.
I ricercatori hanno scoperto che bassi livelli di ossigeno rendono più probabile che i filtri della milza si ostruiscano. Hanno anche dimostrato che l’aumento dei livelli di ossigeno può sbloccare i filtri, il che può aiutare a spiegare come le trasfusioni di sangue aiutino i pazienti che soffrono di questa condizione.
“Se aumentiamo i livelli di ossigeno, invertiremo il blocco”, afferma Ming Dao, uno dei principali ricercatori del Dipartimento di scienza e ingegneria dei materiali del MIT e uno degli autori senior dello studio. “Questo imita ciò che viene fatto quando c’è una crisi di sequestro splenico. La prima cosa che fanno i medici è la trasfusione e, nella maggior parte dei casi, dà sollievo al paziente“.
Subra Suresh, ex decano di ingegneria al MIT, Professore emerito di ingegneria di Vannevar Bush ed ex Presidente della Nanyang Technological University di Singapore; Pierre Buffet, Direttore medico dell’Istituto Pasteur e Professore all’Università di Parigi e George Karniadakis, Professore Robinson e Barstow di Matematica Applicata alla Brown University, sono anche autori senior dello studio. Il postdottorato del MIT Yuhao Qiang è l’autore principale dell’articolo, che appare negli Atti della National Academy of Sciences questa settimana.
Filtri intasati nella milza
La maggior parte dei globuli rossi ha una durata di vita di circa 120 giorni, quindi quasi l’1% della scorta deve essere rimosso ogni giorno. All’interno della milza, il sangue scorre attraverso il tessuto noto come polpa rossa, che contiene stretti passaggi chiamati fessure interendoteliali.
Queste fessure, formate dagli spazi tra le cellule endoteliali che rivestono i vasi sanguigni della milza , hanno dimensioni massime di apertura significativamente inferiori a quelle di un globulo rosso. Tutti i globuli rossi che non riescono a passare attraverso queste minuscole aperture, poiché sono danneggiati, irrigiditi o deformati, rimangono intrappolati e vengono distrutti dalle cellule immunitarie chiamate macrofagi.
Per modellare la funzione di filtrazione della milza, i ricercatori hanno creato un dispositivo microfluidico con due moduli: il chip S, che imita le fessure interendoteliali, e il chip M, che imita i macrofagi. Il dispositivo include anche un canale del gas che può essere utilizzato per controllare la concentrazione di ossigeno di ciascun chip per simulare le condizioni del corpo.
Utilizzando questo dispositivo, i ricercatori hanno cercato di comprendere meglio il sequestro splenico acuto, che si verifica in circa il 5% dei pazienti con anemia falciforme, di solito nei bambini. Quando ciò accade, la milza si ingrossa e il paziente diventa gravemente anemico. I medici di solito lo trattano con trasfusioni di sangue, ma se ciò non aiuta, potrebbe essere necessario rimuovere chirurgicamente la milza.
Lavorando con globuli rossi sani e globuli rossi falciformi di pazienti affetti da anemia falciforme, i ricercatori hanno permesso alle cellule di fluire attraverso il loro dispositivo a livelli di ossigeno controllati.
In normali condizioni di ossigeno (20% di ossigeno) le cellule falciformi creavano un blocco nelle fessure, ma c’era ancora spazio per il passaggio di altre cellule del sangue. Tuttavia, quando il livello di ossigeno è sceso al 2%, le fessure si sono rapidamente bloccate completamente.
Quando i ricercatori hanno nuovamente aumentato il livello di ossigeno, il blocco si è risolto. “Questo potrebbe in parte spiegare perché le trasfusioni di sangue, che portano le cellule del sangue ossigenate nella milza, possono aiutare i pazienti che stanno vivendo un sequestro splenico acuto”, dice Dao.
“I nostri risultati forniscono un quadro scientifico generale per guidare e razionalizzare ciò che i medici osservano. Aiutano anche a chiarire come la milza svolge una funzione fondamentale per aiutare a filtrare le cellule del sangue”, dice Suresh.
I ricercatori hanno scoperto che condizioni leggermente deossigenate (5% di ossigeno) causano un certo intasamento, ma non abbastanza da produrre una crisi di sequestro splenico, il che potrebbe spiegare perché tali crisi si verificano raramente.
Vedi anche:Anemia falciforme: nuova speranza di trattamento
I ricercatori hanno quindi utilizzato l’altro modulo del dispositivo, il chip M, per modellare ciò che accade quando i globuli rossi incontrano i macrofagi in condizioni diverse. Hanno scoperto che quando i livelli di ossigeno erano bassi, i globuli rossi falciformi avevano molte più probabilità di essere intrappolati dai macrofagi e ingeriti da essi. Infatti, sono state catturate così tante cellule del sangue che i macrofagi ne sono stati sopraffatti e non sono riusciti a distruggerle abbastanza velocemente, contribuendo all’ostruzione delle fessure.
I ricercatori hanno anche scoperto che le cellule falciformi rigide conservavano la loro forma falciforme anche dopo essere state ingerite, il che rendeva più difficile per i macrofagi scomporle. “Circa la metà di queste cellule rimane falciforme per molto tempo e rallenta l’intero processo di digestione”, dice Dao.
Quando i livelli di ossigeno sono aumentati, le cellule del sangue hanno riacquistato la loro forma normale, anche le cellule che erano state ingerite. Ciò ha permesso ai macrofagi di digerirle più facilmente e di ripulire i filtri intasati nella milza.
I ricercatori stanno ora utilizzando lo spleen -on-a-chip per studiare come i farmaci usati per trattare l’anemia falciforme, come il Voxelotor e l’Idrossiurea, influenzano il comportamento cellulare che hanno osservato in questo studio. Sperano anche che un giorno il dispositivo possa essere utilizzato per aiutare i medici ad analizzare le cellule del sangue dei singoli pazienti e monitorare l’avanzamento della loro malattia.
“Questo approccio dovrebbe aiutare a progettare test per fornire diagnosi e prognosi specifiche per il paziente”, afferma Buffet, che è anche un medico praticante. “Ciò può dare ai medici un’idea di come sta andando il paziente e in quale situazione è necessario eseguire una splenectomia o adottare altre misure”.
Il team comprendeva anche i postdoc del MIT Ting Dong e Fuyin Zheng, Abdoulaye Sissoko dell’Università di Parigi, Zixiang Liu della Brown University, Fang Kong della Nanyang Technological University e John Higgins del Massachusetts General Hospital.
Fonte:MIT news